在FDA新政策下,昭衍新药的猴子白囤了?
出品 | 妙投APP
作者 | 张贝贝
头图 | AI生图
4月11日,FDA官网更新政策,逐步取消了单克隆抗体疗法等药物研发对临床试验的强制性要求,引起了业界的极大关注。以临床试验为主,拥有美国业务的昭衍药物将率先受到冲击。
事实上,FDA在2022年通过了《FDA现代化法案2.0》,倡导寻找临床试验的替代方案,但最新政策更具体,指出了智能计算模型、类器官和器官芯片、跨物种数据整合三个替代方向。这也是消息一经发布,市场关注度较高的重要原因。
受此消息影响,昭衍药品金融市场当天直接下跌。
然而,市场对此存在很大争议。有人认为“不用动物直接在人身上做实验,这不是开玩笑吗?”也有人认为这是中国很多猴子,特意出台了政策限制;但也有人认为,可能不是空穴来风,真的有可能实现,因为给出了更具体的替代思路。如果是这样的话,昭衍新药的猴子可能会白囤。
接下来,从临床实验取代方案的可行性和昭衍药物中美业务比例来看,分析了该政策对昭衍新药业务的短期、中长期影响。
虽然临床试验没有被禁止,但是将来可能会减少。
事实上,撤销临床试验的相关话题,这两年一直在业界讨论。
几十年来,动物一直是新药研究的关键。由于许多动物在生物学上与人类完全相似,并且会患上与人类相同的疾病,动物实验可以在很大程度上避免人类可能出现的危险。
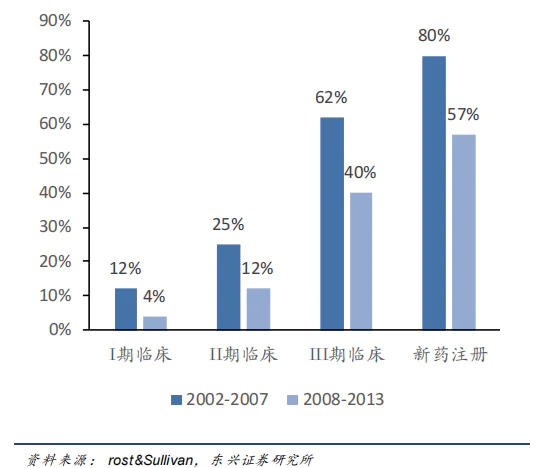
然而,反对者认为动物测试太残酷了。每年都有那么多动物死亡,太不人道了。此外,动物测试不能完全可靠地预测人体测试结果。毕竟动物身上有很多药是好的,但是不能给人。例如,在2008-2013年期间,新药临床试验1期、2期、3期及新药注册通过率分别为4%。、12%、40%和57%,能看到动物上安全有效的药物,只有不到1%的药物成功获批。
此外,临床试验成本高,试验时间长,动物实验室的管理和运营也相当繁琐。例如,一般需要使用144只非人类动物来开发单抗,每只动物的成本高达5万美元(FDA发布的路线图),成本高。
从这个意义上说,如果FDA推动器官芯片和AI逐渐取代实验动物,那将是医药行业新药研究的里程碑事件。从这个维度来看,FDA的动物试验替代政策对全球新药研究产生了影响,或者说不仅仅是对国内CXO公司的打击。
所以,替代方案的可行性到底是什么?
让我们来看看近年来流行的AI技术。FDA鼓励开发者使用计算机建模和人工智能来预测药物的行为。例如,软件模型可以模拟单抗在人体内的分布特征,并根据这种分布和药物的分子构成可靠的预测副作用。这项技术需要实验验证。
与AI相比,器官芯片技术并不是一个全新的术语和技术,它们已经存在了十多年。其中,器官芯片可以通过工程控制器官的生理剪切力等微环境,进一步提高模型仿真度,在芯片上构建3D人体器官生理微系统,基于类器官(通过自组装模拟人体组织和器官功能)。
而且器官芯片技术在药物研发方面有着本质的进步。
根据公开信息,2022年8月,FDA允许赛诺菲的新药(NCT04658472)进入临床试验,即基于器官芯片研究获得的临床前数据,这也是FDA第一次允许将完全依赖非动物试验数据的新药进入临床试验。
这就是说,FDA这次并非“拍脑门”的政策,或许有一定的依据。
但是需要注意的是,器官芯片在临床试验申请中的成功应用有一个重要前提,那就是NCT04658472之前已经被FDA允许用于其他适应症,现有的动物试验安全数据得到了支持,而器官芯片只提供了新适应症的临床前疗效数据,并没有完全取代临床试验。(本临床试验是治疗两种罕见的自身免疫性脱鞘神经疾病,以前缺乏理想的动物模型,不能对此进行研究)
然后,虽然器官芯片数据在新药研究领域取得了进展,但在动物实验的基础上,新的适应证提供了临床前疗效数据,并没有完全取代临床实验。从这个维度来看,短期内很难完全禁止动物实验,但可能会减少。例如,在新的适应症开发中,非动物实验被取代。
此外,根据FDA路线图的降低动物测试测试计划,我们可以看到,在未来三年内,将使用单克隆抗体。(mAb)药品为试点商品,从常规6个月到3个月,减少灵长类动物长期毒性试验;同时,建立国际药物毒性数据库,利用现有临床数据替代部分临床试验。未来3-5年,动物试验将成为临床前安全试验的“例外”,而不是“常规”。
从上面也可以看出,至少在未来3-5年内,动物试验不会被完全取消,只会减少使用。

关键是,在这种情况下,昭衍药物会受到什么影响?
寻找其它的“出路”,刻不容缓?
昭衍药品是国内以非临床研究业务为主的CRO公司,2024年收入贡献高达95%。其中,动物实验占70%左右,这部分业务在未来将受到上述FDA政策的直接影响。
而且需要注意的是,虽然昭衍药品78%的业务来自中国市场,但只有22%的业务来自海外(主要是美国)。但是,参考国内第一家从事类器官的公司 AI“希格生科创始人兼首席执行官张海生博士表示,目前,希格生科与北京大学、清华大学、大连化学研究所等高校科研机构,以及中国检验院和美国食品药品监督管理局正在积极推进器官技术行业标准的交流和制定,以促进器官和器官芯片技术的进步(来自同写意《FDA终结百年临床实验史》)。
可以看出,中国药品监督管理机构也在积极推进类器官等技术。
然后,2025年,由于FDA政策刚刚实施,可能对企业的经营影响不大。然而,未来几年,昭衍新药的动物实验业务将处于“达摩克利斯之刃”悬在头顶的境地。
结合财务报告,2019-2024年,企业增加了约1758种生物药物、约1276种化学药物和50多种中药非临床研究项目。企业一半的非临床业务可能是生物药物。结合近年来国内药企在单抗药物领域的聚集布局,昭衍新药在动物试验中可能存在较大比例的单抗药物订单。如果占一半,单抗药品订单在企业整体业绩中的比例可能达到:70%*50%*50%=17.5%。
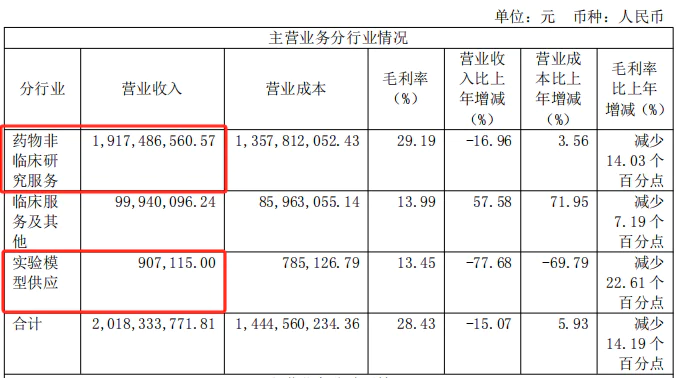
此外,如果未来动物测试减少,猴子的价格可能会下降。从目前的10万元降价到疫情前的几千元也不是不可能。在此前提下,昭衍药物在猴场建造的“猴子”也将面临损失。当然,测试模型的销售也会承受压力。
到那时,公司的业绩增长将主要压在临床业务上。
但需要注意的是,昭衍新药的临床业务主要处于初期临床阶段,国内CRO几乎都在向临床业务拓展,竞争激烈。这也是为什么,虽然2024年昭衍新药的临床业务在扩张下收入有所增加,但在市场竞争下,业务毛利率下降,显然很难扛起“赚钱的旗帜”。
从上面可以看出,即使昭衍药物短期内没有受到太大的干扰,毕竟未来1-3年将是单抗产品作为试点的测试期,但从长远来看,如果未来的动物测试“成为例外而非常规”,如果昭衍药物没有其他新业务贡献更多的业绩增量,业绩提升将承受更大的压力。从这个维度来看,昭衍药物未来能否找到新的“出路”,或者变得尤为关键。
免责声明:本文内容仅供参考,本文所表达的信息或意见不构成任何投资建议,请谨慎作出投资决策。
—————▪征集作者粉丝团▪—————
如果读者对本文有疑问,可以长按下面的二维码,添加好友,与作者进行一对一的交流。
另外,作者对CXO也是如此。、医疗美容、药店、血液制品、阿兹海默概念、多肽减肥药等领域都有主题机会,重点分析行业分析和布局公司的优缺点。感兴趣的读者可以长时间按下二维码,与作者进行更多热门跑道和相关上市公司的深入交流。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





