国产口服GLP-1的市场窗口正在收窄
辉瑞对口服GLP-1药物的布局仍在持续。
在终止口服GLP-1核心管线danuglipron研发的八个月后,辉瑞再次通过合作引入口服GLP-1资产。12月9日,复星医药发布公告,宣布将自主研发的小分子胰高血糖素样肽-1受体(GLP-1R)激动剂YP05002的全球独家权益授予辉瑞。为获得YP05002,辉瑞支付了1.5亿美元首付款,同时还需支付潜在的3.5亿美元研发里程碑款和15.85亿美元销售里程碑款。
对于熟悉高额BD交易的中国投资者来说,复星医药与辉瑞的此次合作可能不算特别引人注目。但结合当前GLP-1赛道的激烈竞争环境分析,辉瑞的选择具有特殊意义:它没有选择临床进度更快的产品,反而确定了复星医药这款仍处于临床早期阶段的药物。这种“反常规”选择背后的潜台词,恰恰反映出其他国产口服GLP-1药物面临的尴尬局面。
目前,辉瑞、默沙东、阿斯利康等跨国药企(MNC)都已通过BD合作完成了口服GLP-1领域的核心布局,其他国产口服GLP-1产品的市场机会正变得越来越有限。
01 辉瑞的口服GLP-1研发困境
在热门的口服GLP-1赛道上,辉瑞曾多次投入大量资源。
在与复星医药达成合作之前,辉瑞曾独立研发过三款口服小分子GLP-1药物,但最终这三条自研管线都终止了临床试验。
早在2023年6月,辉瑞就因安全性问题终止了首款口服小分子GLP-1药物lotiglipron的研发。作为每日一次给药的小分子药物,lotiglipron在临床早期展现出一定的降糖和减重效果——I期临床数据显示,患者用药4周后体重下降2.1%(经安慰剂校正后为1.5%)。但遗憾的是,该药物存在明显的安全性隐患,有35%的受试者出现转氨酶升高的情况。转氨酶是评估肝脏功能的重要指标,其水平升高通常意味着肝脏可能受到损伤,基于这一问题,辉瑞果断终止了该药物的后续研发。
对于当时的辉瑞而言,lotiglipron的失败并未动摇其在该领域的信心,主要原因是还有另一款口服小分子GLP-1产品danuglipron。最初,danuglipron被设计为每日口服2次的剂型,但在临床研究中暴露出严重的耐受性问题:给药32周时,73%的患者出现恶心症状,47%的患者发生呕吐,严重的副作用导致超过50%的患者中途停药。由于患者依从性不足,辉瑞首次暂停了danuglipron的研发。
尽管如此,danuglipron在32周临床研究中实现8%-13%体重降幅的数据,仍让辉瑞难以放弃。为此,辉瑞尝试通过优化给药方案来挽救这款“潜力药物”,将其调整为每日1次的优选缓释制剂,希望以此降低副作用发生率。然而,danuglipron最终还是没能通过安全性这一关:改良后的制剂虽然达到了预期的药代动力学目标,但研究中出现了1例无症状受试者发生潜在药物诱导性严重肝损伤的案例。最终,辉瑞在今年4月彻底放弃了danuglipron的研发。
除了上述两款自主研发的药物外,辉瑞还曾与Sosei公司合作开发口服小分子GLP-1药物PF-06954522。与前两款因安全性问题失败的产品不同,PF-06954522没有出现明显的安全性问题,但其临床数据未能体现出足够的市场竞争力,最终辉瑞在今年8月宣布终止该药物的研发。
为研发这三款药物,辉瑞总共投入了高达12亿美元,但最终只得到了失败的结果。
02 优质BD交易的核心在于务实
“BD为王”的热潮席卷医药行业,各类BD交易层出不穷,但其中不少交易实际上是为了迎合投资者的偏好而设置的。事实上,真正优质的BD交易往往简洁务实,复星医药与辉瑞围绕YP05002的合作就是一个典型例子。
从YP05002的交易条款来看,双方没有设置任何复杂的设计。虽然交易的绝对金额不算特别高,但核心内容都很明确,投资者能从中清楚地感受到双方的合作诚意。
首先是1.5亿美元的首付款,对于仅处于临床一期的YP05002来说,这样的交易金额并不低。此前翰森制药关于口服小分子GLP-1药物HS-10535的交易中,默沙东的首付款为1.12亿美元,略低于辉瑞的1.5亿美元,不过当时HS-10535还处于临床前阶段。
其次是3.5亿美元的研发里程碑付款和15.85亿美元的销售里程碑付款。这种款项结构设计有其深意:既体现了复星医药对YP05002未来商业化前景的充分信心——核心里程碑金额需要在产品商业化后才能兑现;也反映出在口服GLP-1领域连续三次失败的辉瑞的谨慎态度。“好产品用销售证明价值”,这种以市场表现为核心的交易逻辑,充分体现了公平性。
当然,除了公平的条款设计外,这笔交易还有一个更关键的价值点:成功占据了本就稀缺的口服小分子GLP-1药物BD市场空间,相当于显著提升了YP05002在行业内的地位。按照之前的临床进度排序,仅处于临床一期的YP05002原本并不突出,歌礼药业、通化东宝、华东医药等企业的同类型药物研发进度都处于领先位置,但辉瑞最终选择了YP05002而非这些头部产品。
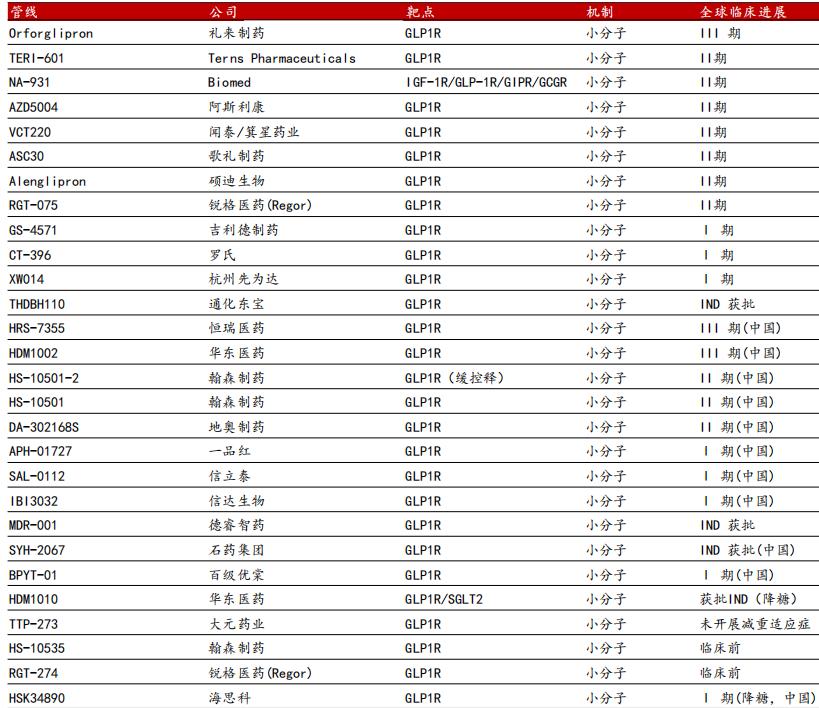
图:口服GLP-1药物研发一览,来源:麦高证券
背后的原因可能与BD报价有关,也可能是出于对药物安全性的考虑,但可以肯定的是,复星医药与辉瑞达成合作后,国内口服小分子GLP-1药物的BD市场空间将进一步被压缩。一方面,行业内愿意为该领域资产支付高价的BD买家又减少了一个;另一方面,双方这份充满诚意的交易条款将成为行业标杆,为后续企业的BD谈判设定了非常实际的参考标准。
对于那些仍在寻求合作的国产小分子GLP-1药物来说,它们的BD机会可能真的不多了。
本文基于公开资料撰写,仅作为信息交流使用,不构成任何投资建议。
本文来自微信公众号“医曜”,作者:林药师,36氪经授权发布。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





