脂肪酸摄入与癌症:京都大学揭示了防癌饮食的新途径
原创 转网 转化医学网

【介绍】众所周知,脂肪酸对癌细胞的特性有很大的影响。因此,这些化合物已经被纳入治疗策略。本研究分析了各种脂肪酸对癌细胞的影响,发现硬脂酸(丰富的饱和脂肪)通过非折叠蛋白反应(UPR)与棕榈酸(也是一种丰富的饱和脂肪)相比,诱导DNA损伤和细胞坏死对细胞生长的抑制作用更强。
2024年12月2日,Masaki日本京都大学 Mandai 期刊上的教授团队《Experimental & Molecular Medicine》上面发表了题为“A stearate-rich diet and oleate restriction directly inhibit tumor growth via the unfolded protein response"研究论文。该研究表明,通过DNA损伤和UPR介导的细胞坏死机制,可以直接抑制饮食中的硬脂酸盐的肿瘤生长。这项研究表明,饮食中的硬脂酸盐可以直接抑制肿瘤的生长,这涉及到DNA损伤和UPR介导的细胞坏死的机制。通过饮食干预提高硬脂酸水平,降低油酸水平,可能是一个很有前途的癌症治疗策略。

https://www.nature.com/articles/s12276-024-01356-2
肥胖与癌症
01
肥胖会增加致癌风险。因此,过量摄入膳食脂肪会增加癌症的风险,加重癌症状态下癌症的恶性程度,并可能导致不良的临床效果。然而,脂肪酸并不是普遍有害的,它对癌细胞的影响因脂肪酸类型而异。
在这项研究中,该团队旨在调查棕榈酸酯、硬脂酸酯和油酸酯对癌细胞的影响,以及饮食变化是否会产生足够的临床影响。因此,除了一般的高密度脂蛋白饮食(HFD)此外,该团队还采用了独特的高密度脂蛋白膳食,含有硬脂酸盐。(S-HFD),讨论饮食中硬脂酸盐和油酸盐对体内癌症的不同影响。
在抑制不饱和度的同时,在饮食中补充硬脂酸盐会干扰肿瘤的生长,而补充油酸盐会逆转这种情况。
02
皮内注射SCD1与NFD组相比。-knockdown (SCD1-KD) S-HFD组的OVCAR5细胞显著抑制了肿瘤的生长(SCD1-KD和KDS-HFD vs. SCD1-KD和NFD;0.125g vs. 0.240g)。相反,O-HFD组的肿瘤生长速度明显高于S-HFD组和NFD组。采用sh对比细胞系的实验,S-与NFD组和O-HFD组相比,HFD组表现出更强的生长抑制作用,尽管这种趋势并不像在使用SCD1-KD细胞实验时所看到的那样明显(sh比较和SH比较-HFD vs. sh对比和O-HFD;0.2633g vs. 0.4017g)。另外,在O-HFD组中,sh对照组和SCD1-KD细胞之间的肿瘤生长没有明显的差异。

在饮食中补充硬脂酸盐,抑制不饱和会干扰肿瘤的生长,而在添加油酸盐之后,这种情况就会发生逆转。
对卵巢癌病人进行异种移植,补充硬脂酸盐,抑制不饱和(PDX)该模型具有显著的抗增殖作用。
03
根据PDX72的研究,独立服用CAY10566可以抑制肿瘤的生长,而S-HFD可以进一步增强小鼠的这种效果。(NFD-vehicle)。但是,尽管CAY10566已经治愈,但是喂食O-HFD小鼠的肿瘤明显大于喂食S-HFD 的小鼠(S-HFD-CAY10566:150mg vs. O-HFD-CAY10566:798.3mg)。
对于这两种PDX模型UPR模型、IHC对DNA损伤和细胞坏死标志物的分析结果是一致的;CHOP、γCAY105666,H2AX和裂化的caspase-3 S-在O-HFD组中,HFD组的水平最高,而这些标志物的水平明显下降。
总而言之,CAY10566和S-HFD在两种临床背景和结果不同的PDX模型中可以显著抑制肿瘤的生长。另外,即使是对CAY10566单药敏感的病例,服用O-HFD后肿瘤增殖也会增强,这表明CAY10566的抗肿瘤作用会受到O-HFD的影响。
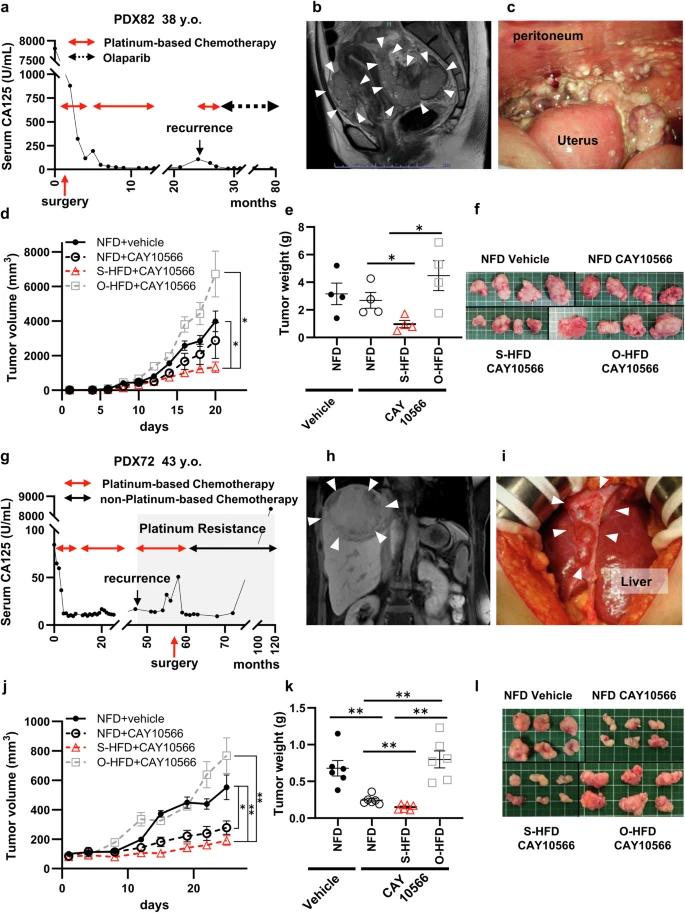
异种移植卵巢癌病人(PDX)在模型中,补充硬脂酸盐和抑制不饱和都有显著的抗增殖作用。
总结
04
1. 长链脂肪酸对癌细胞增殖的影响:饱和脂肪酸棕榈酸酯和硬脂酸酯(SFAs)能抑制癌细胞株的生长。
2. 硬脂酸酯和棕榈酸酯的区别:硬脂酸酯比棕榈酸酯具有更强的抗癌细胞增殖作用,特别是诱导未折叠蛋白质反应。(UPR)通道上存在明显的差异。
3. 硬脂酸酯的细胞毒性作用:硬脂酸酯对卵巢癌细胞系统和正常人卵巢表面上皮细胞系统有很强的影响,表明卵巢组织对硬脂酸盐的细胞毒性作用可能更加敏感。
4. 饮食调节的抗增殖作用:S-HFD(含硬脂酸盐饮食)和SCD(硬脂酰辅酶A去饱和酶)抑制剂可以在老鼠体内发挥最有效的抗增殖作用,说明饮食调节可以抑制肿瘤的生长。
5. 膳食脂肪变化和抗肿瘤作用:硬脂酸酯含量的大幅增加是产生抗肿瘤作用的关键,而非棕榈酸酯。
6. 卵巢癌治疗的临床潜力:在抗药性肿瘤的PDX小鼠身上观察到类似的饮食调节和抗癌效果,表明对UPR饮食干预的治疗可能是一种高级浆液性卵巢癌。(HGSC)的新方法。
7. 饮食调节的抗肿瘤作用:饮食调节可以直接产生抗肿瘤作用,扩大饮食干预在癌症治疗中的应用范围。
8. 基于证据的癌症治疗膳食干预:这些发现对于开发更多基于证据的癌症治疗膳食干预非常有价值,尤其是在抗药性肿瘤治疗中。
参考资料:
1.Lauby-Secretan, B. et al. Body fatness and cancer-viewpoint of the IARC working group. N. Engl. J. Med. 375, 794–798 (2016).
2.Yang, J. et al. High-fat diet promotes colorectal tumorigenesis through modulating gut microbiota and metabolites. Gastroenterology 162, 135–149.e2 (2022).
阅读原文
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com


