AlphaFold 三是重磅发布,谷歌开放AI药物研发市场1000亿美元
文|李苗 陈斯达
编辑|李然
五月九日,谷歌DeepMind再次更新了AlphaFold,推出了AlphaFold的全新生命分子结构预测模型。 3。AlphaFold 2 AlphaFold已经成为“行业最强” 3直接将预测范围,从蛋白质结构扩展到大多数生命分子,精度也翻了一番。
AlphaFold的飞跃式进展 第三篇论文登上了Nature头条。
具体而言,这次AlphaFold 3升级,主要是通过Diffusion加入, Model,通过对原子3D坐标的直接预测,成功地将AI对蛋白质的预测能力扩展到包括DNA、RNA等领域。能对付蛋白质,DNA 和 RNA 各大生物分子、小分子(又称配体)、也有很多药物可以预测。
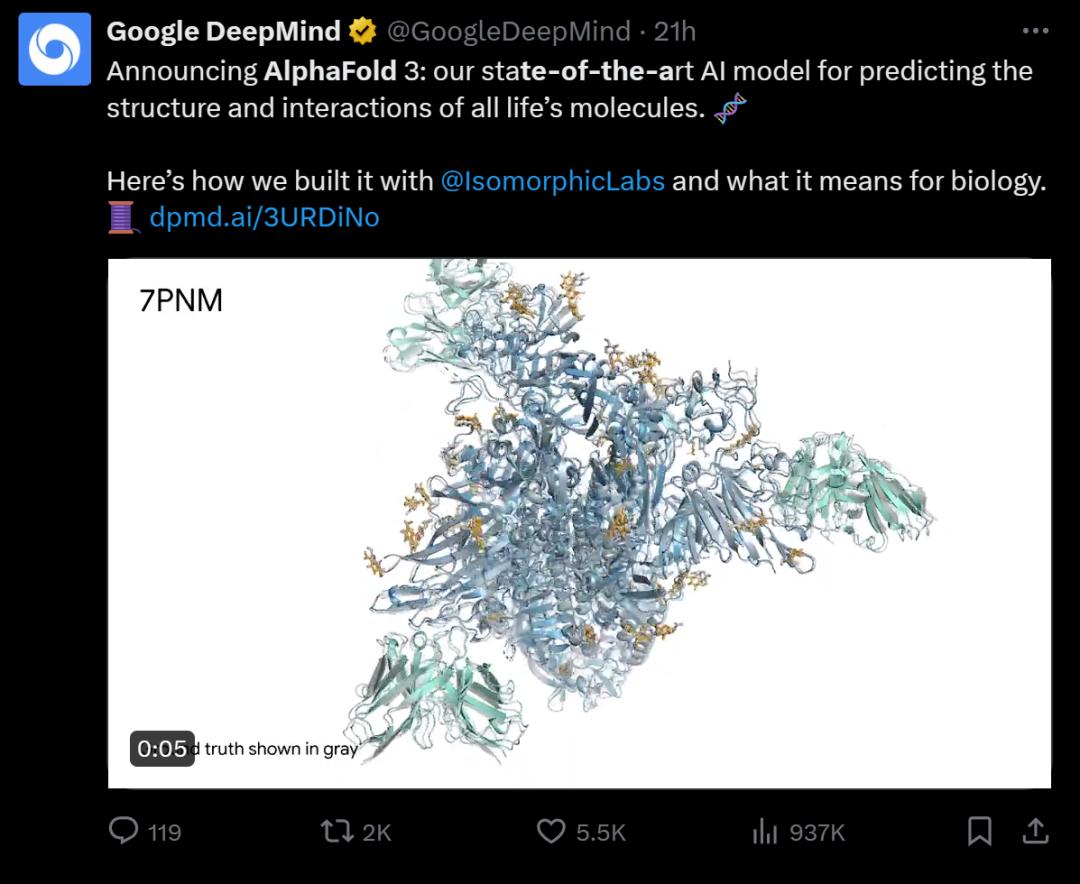
比如,AlphaFold 3对新冠状病毒OC43的刺突蛋白进行了成功的预测,预测结果(绿色和黄色部分)与真实情况(灰色部分)高度一致。
AlphaFold 预测三种分子复合物:
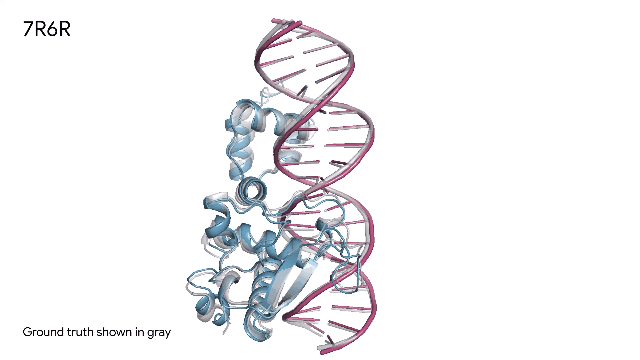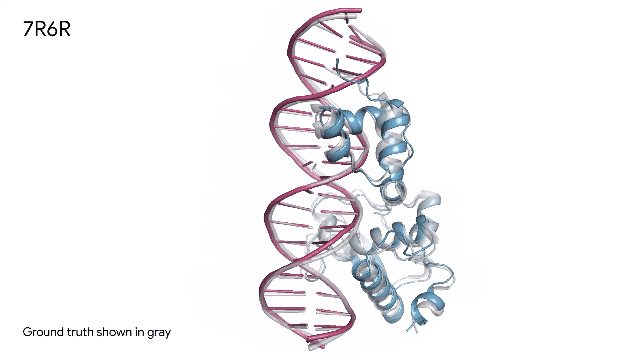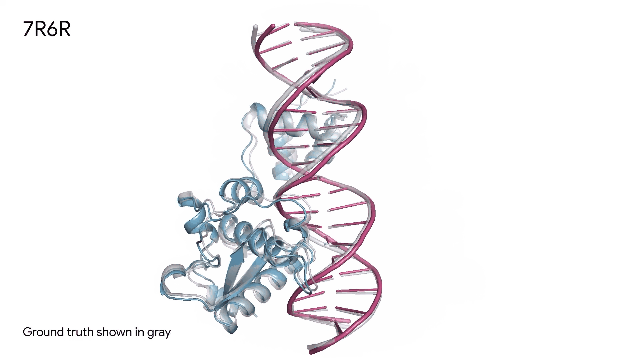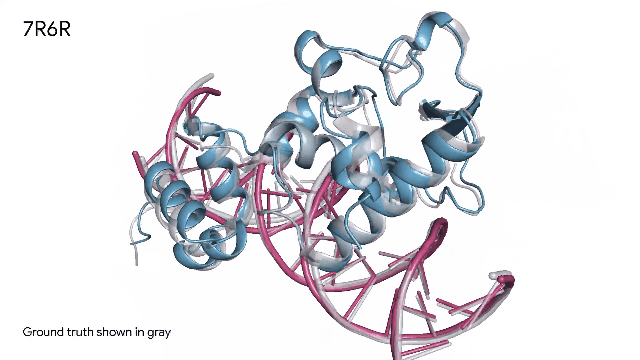
蛋白质(蓝色)和DNA双螺旋(粉色)组合在一起。实验中发现的真实分子结构(灰色)的预测结果与实验结果几乎完美匹配。

AlphaFold 在大大拓展了AI预测生物分子能力的边界之后,也为以科研结果为基础的未来商业化开辟了无限可能。DeepMind CEO 在接受彭博社采访时,Hassabis也表示,AlphaFold 三是加快生物学研究,药品研发市场将超过1000亿美元。
他强调: 对于药物发现尤为重要,分子结构预测需要考虑不同生物分子之间相互作用的能力。AlphaFold 3具备的能力,对包括疫苗在内的新药所采用的化合物进行设计和测试,具有重要作用。
在不久的将来,他预计将会有大量的人工智能药物进入临床实践,给人们的生命健康带来极大的好处。
网民们也对DeepMind的突破感到惊讶,有评论称这一结果为“上帝之母”。
"大进步!癌症都要瑟瑟发抖!"
预测效果显著提高,直指药物研发
在AI引入之前,只有少数蛋白质的结构是真正研究出来的。
AlphaFold1于2018年12月在43种蛋白质中成功预测了25种蛋白质的结构,并以最高分获得了第13种蛋白质结构预测技术的重点评价。(CASP)。AlphaFold 22020年的CASP,以高于90%的准确率,再一次将其他球员甩在后面。
虽然没有完全解决蛋白质折叠的问题,但是AlphaFold 第二代表的技术进步意味着,与实验室方法相比,计算生物能够产生相当精确的蛋白质结构预测结果,成本也大大降低。
2023年10月底,Alphafold-latest发布,预测蛋白质结构更准确。在此基础上,其他生物分子结构的预测,如核酸、随机小分子配体等,意味着所有重要生物分子及其相互作用的原子级精确结构可以通过AlphaFold的方法进行预测。
如今看来,Alphafold-这次AlphaFoldatest就是这次。 3的“预告片”。
AlphaFold Hassabis在发布后告诉媒体:“生物学是一个动态系统,生长习性是通过细胞中不同分子之间的相互作用而显现出来的,你可以把AlphaFold 三视为人类向(建模)目标迈出的第一步。
而且这一历史性的一步,仍然是建立在Transformer和Diffusion模型之上,这是近年来AI领域最热门的。
介绍论文内容

论文地址:https://www.nature.com/articles/s41586-024-07487-w
AlphaFold 三是通过设计一个开创性的框架,巧妙地将Transformer和Diffusion模型结合起来,从而解决了AlphaFold 二是进一步提高蛋白质的预测精度,同时将预测范围扩大到其它分子。
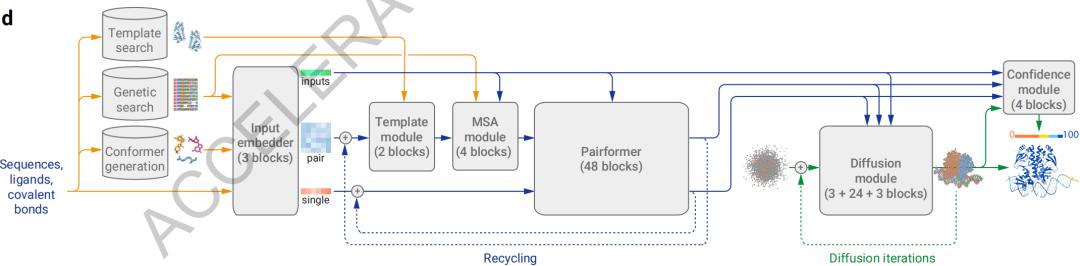
AlphaFold 2基础之上,AlphaFold 三是改进了底层模型框架,转变为“扩散技术”。传播过程从原子云开始,经过多个步骤,形成最精确的分子结构。这种技术主要用于OpenAIDALL。-E 2 和 Sora 在图像和视频生成领域,原理是逐步做“减法”——从一个纯噪音图像慢慢降低噪音,直到“雕刻”出准确的预测图像。这种方法使AlphaFold 3更多的输入集可以处理。
关于底层结构变更的细节,Alpha Fold 3 简化了遗传特性编码器(MSA module),双残基关系编码器(Pairformer)它还取代了原来的进化特性控制部件。(Evoformer),增强了复杂相互作用模式的建模能力。结构生成器在生成阶段可以直接预测原子坐标,比以氨基酸为核心的方法提供了更高的灵活性和精度。
效果是显而易见的。对蛋白质与其它分子类型相互作用的预测效果,AlphaFold3至少可以提高50% ,对特定类别而言,预测精度翻倍。就预测范围而言,AlphaFold 3不仅可以模拟大型生物分子,如蛋白质、DNA和RNA,还可以处理小分子,如药物研发中的配体,实现联合预测和研究分子之间的相互作用。在AlphaFold2NA中,RoseTTAFold2NA只能处理1000个残基以下的结构, 3能处理残基倍率于此的结构。
预测成千上万个残基结构?
举例说明联合预测模型
JohndDeepMind总监 Jumper表示,这标志着模型“大演变”, 确实简化了使不同原子协调工作的全过程。
虽然精度有了很大的提高,但是“传播技术”最大的问题还是在于“幻觉”,此外,它的知识范围仅限于训练中使用的PBD数据。为了防止扩散方法在一些无结构区域产生幻觉,通过AlphaFold引入了一种新的交叉蒸馏方法-Multimer 对结构数据进行V2预测,以丰富训练数据,从而降低幻觉的可能性。
不再开源,科学研究的终点是建立商业帝国
DeepMind将于2021年7月举行。AlphaFold 2开源。目前看来,DeepMind不会发布AlphaFold。 3代码,非商业用途只能通过DeepMind网站进行研究。
“用户可以通过谷歌推出”AlphaFold Server"访问AlphaFold 虽然一天只能产生10次,而且不能产生与制药有关的分子。
2021年11月,谷歌母公司Alphabet开始推动AlphaFold项目的商业化。子公司Isomorphic 成立Labs的目的是利用人工智能加速药物的发现,寻找治疗方案。
Isomorphic Labs专注于小分子药物的开发,药物通常用于靶向治疗。公司创始人兼首席执行官 Demis Hassabis,同时也是DeepMind的创始人和CEO,首席科学家和首席AI官员在AI中。、在药物发现和跨学科研究方面有很多经验。
2024年1月初,Isomorphic Labs宣布与全球制药巨头礼来与诺华建立战略合作,并声称合作可能会给公司带来近30亿美元的价值(甚至不包括未来药品销售中可能出现的特许权使用费)。
巨人们总是提前进入市场。这个合作时间点,正好在Alphafold-latest预告片发布后,Alphafold 三是正式发布之前。
许多玩家对Deepmind的效果感到惊讶。AlphaFold不仅依靠谷歌母公司Alphabet的强大计算能力和资金,而且很早就成为业界应用最广泛的蛋白质预测AI模型,也吸引了许多第三方研究团队在其模型的基础上进行调整。
AI制药初创逆势而上,千亿美元市场隐藏。
近十年来,投资者向AI驱动的生物技术公司投资超过180亿美元。随着AI的普及,药物发现速度更快,成本更低。据彭博社报道,越来越多的制药公司、投资者和像英伟达这样的科技巨头正在进入这个超过500亿美元的市场。
AI开发骨质疏松药,获英伟达投资
近年来,英伟达疯狂下注AI制药创业公司。2024年3月,英伟达再次投资计算药物,发现创业公司Relation。 Therapeutics。Relation 根据骨质疏松,Therapeutics核心项目已经达到种子轮融资总额。 6000 万美金。

一家公司成立了 “骨组学 (osteomics)"平台,对人体成骨细胞进行全基因组和 RNA 测序。在AI模型中输入这些数据后,可以识别与疾病风险相关的基因突变。Relation采用CRISPR基因敲除单一或成对疾病风险基因,并研究其对骨矿化(骨质疏松症的标志物)的影响,以测试这些相关性。
这种 实验室内循环 "Relation的能力不同于许多其它人工智能驱动的生物技术创业公司。这样公司就可以把它做好 22000个人类基因的搜索空间缩小到数百个与骨质疏松症有关的基因。到目前为止,该公司发现的许多疾病风险基因与现有骨质疏松文献中的基因一致,验证了“骨组学”平台的有效性。伴随着关联基因的发现,人们对骨质疏松症的发病机制有了新的认识。
在过去,这样的研究路径需要许多实验室和研究人员在十年或更长时间内工作,但Relation的整合方法可以在短短几年内完成这个过程。最终目标是将实验室数据与机器学习预测相结合,找到可能的治疗方法,从而在临床上检测出对骨质疏松症的安全性和有效性。
Meta蛋白团队负责人,重建一个AlphaFold
Meta于2023年8月解散了一支致力于AI预测蛋白质结构的大型模型团队,将精力转化为更有可能创收的AI项目。要知道,在2022年7月,它推出的蛋白质结构预测模型ESMFold也可以与AlphaFold相结合。 2较量一番。
被裁去前 Meta AI Alexander蛋白折叠团队负责人 Rives,随后创立“AI 创业公司蛋白折叠 EvolutionaryScale,截至2023年6月,完成种子轮融资。 4000 万美金。
EvolutionaryScale的目的是每年建立一个新的模型,类似于DeepMind的方向。未来,仅仅预测蛋白质结构就可以开发出来,整合来自 DNA 其它生物数据的序列、基因表达和表观遗传状态。未来,它的愿景是销售一种通用的生物人工智能模型。
理论上,这种模式可以用于医学,例如开发“可编程细胞寻找和消除癌症或某些疾病”,也可以用于其他生物技术的应用,例如设计“分子机”来清理有毒废物或捕捉碳。
肿瘤药物的AI研发
2023 年 10 月,Iambic Therapeutics 为AI支持的肿瘤药物开发筹集1亿美元。该公司拥有人工智能算法平台,包括 NeuralPLexer 和 OrbNet,目前,该技术已经产生了四种人工智能发现分子,计划在 2024 每年进入临床试验。

同年,Pharos IBioAI药物发现平台Chemiverse采用多种人工智能技术对靶向抗癌药物进行识别和开发。使用Chemiverse,Pharos PHI-101已成功识别并开发,这种靶向抗癌药物可以抵抗急性髓细胞白血病,约30%至35%。(AML)在临床耐铂复发性卵巢癌方面,病人中发现的FLT3基因变异,科研人员也在测试备选药物的潜力。
到目前为止,AI制药行业还没有产生任何批准上市的药物。AlphaFold 3出现,或许可以让“AI “制药”的追随者更有信心。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com


