饿一饿为何更健康?复旦雷群英团队Nature发文揭秘
饿一饿为何更健康?复旦科研团队的最新成果给出了答案。
北京时间2025年11月13日零点,复旦大学基础医学院雷群英团队在《自然》(Nature)在线发表了题为“Cytosolic acetyl - coenzyme A is a signalling metabolite to control mitophagy”的研究论文。这项历经近十年探索的研究,首次揭示了乙酰辅酶A作为“代谢信使”的非经典功能,突破传统认知,发现其可直接调控线粒体自噬,还为克服胰腺癌KRAS抑制剂耐药提供了全新治疗靶点,在代谢生物学与肿瘤学交叉领域取得突破性进展。
近年来,“轻断食”在全球流行。只需简单控制进食时间,让身体保持适度饥饿,不仅能调动脂肪、稳定血糖,还能清除体内的老废代谢物。雷群英团队的研究为这一现象提供了前所未有的答案。
细胞在营养匮乏时,名为“乙酰辅酶A”的“神秘信使”悄然出动,绕过科学家熟知的AMPK和mTOR这两条营养感知的“经典主干道”,独辟蹊径,将“饥饿”信号直抵细胞能量工厂线粒体,指挥“哨兵”NLRX1做出响应。这项发现如同在细胞这座精密城市中,发现了一条此前地图上从未标注,却能直达指挥中心的“秘密通道”。它不仅从根本层面解释了“适度饥饿”如何触发身体的积极反应,更为未来对抗代谢性疾病、癌症乃至延缓衰老开辟了全新的研究疆域。
跳出思维惯性,破解乙酰辅酶A新身份。如果把细胞想象成城市,线粒体就是城里的发电厂。很多老旧发电厂(功能失调的线粒体)还在运行,产生自由基,造成氧化应激,危及城市活力。适度饥饿相当于城市改造,启动“线粒体自噬”,清理效率低下、污染严重的老旧发电厂。
乙酰辅酶A是城市的“核心原料”,既能连接供应商制成燃料棒供发电厂发电,也能用于建造脂肪组织或加固细胞膜,推动城市扩张。过去认为,乙酰辅酶A的行动听命于AMPK和mTOR这两位“管家”。但雷群英团队发现,发电厂外的乙酰辅酶A本身就是“秘密特使”,无需AMPK和mTOR指令,就能通过外部乙酰辅酶A的波动直接控制发电厂,进行“城市更新”(线粒体自噬),影响城市命运。
复旦大学基础医学院/肿瘤研究所教授雷群英回忆,2016年底她和团队成员就立下目标,要做不依赖经典代谢感知通路的创新研究。团队模拟人体“温和饥饿”环境,用接近人体过夜饥饿的营养成分配制培养基。实验结果令人惊讶,线粒体自噬显著启动,但AMPK和mTOR这两个“细胞营养感知管家”却无反应。雷群英表示,这说明细胞里有一条未被发现的“新通道”,专门在生理饥饿时调控线粒体自噬。

雷群英教授(前排居中)与团队在实验室讨论
这一发现让团队信心大增。肿瘤研究所助理研究员张一凡说,为说服审稿人,需要更多证据明确乙酰辅酶A发挥作用的落脚点。为此,团队开启“疯狂”养细胞模式,实验室最多时同时养了200盘细胞。
大海捞针,锁定“神秘信使”的“接头哨兵”。真正的挑战是从海量基因中找出关键“钥匙”。团队用全基因组CRISPR/Cas9筛选技术,在两万多个基因中搜索,最终锁定关键蛋白——NLRX1。这个此前仅在抵抗细菌感染时被“激活”的线粒体哨兵,在此次研究中发挥了全新且重要的作用。
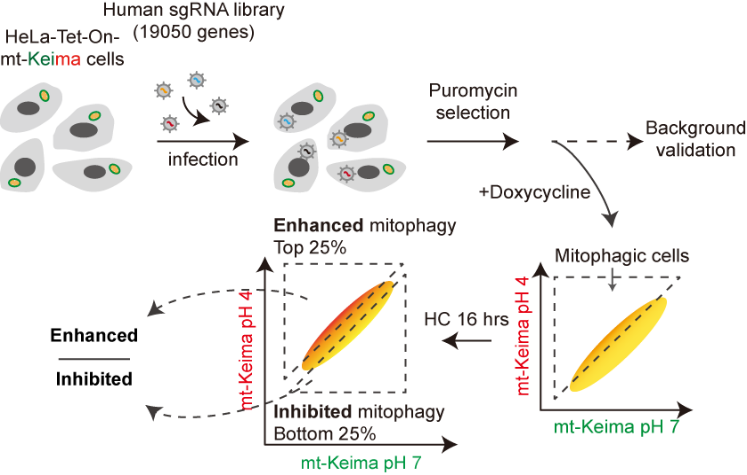
HC诱导的线粒体自噬全基因组CRISPR筛选策略
将全基因组CRISPR文库慢病毒感染稳定表达多西环素诱导型mt - Keima报告基因的HeLa细胞,经过嘌呤霉素筛选扩增,经多西环素诱导mt - Keima表达后用HC处理诱导线粒体自噬。最终,通过流式细胞术分选细胞并进行测序分析。
研究发现,在细胞和活体小鼠模型中,一旦NLRX1被“敲除”,由乙酰辅酶A下降触发的线粒体自噬就会停止,而普通细胞自噬不受影响。肿瘤研究所副研究员尹淼解释,NLRX1是新通路上“不可替代的关口哨兵”,只有它在位,乙酰辅酶A发出的“饥饿”指令才能传递,启动对线粒体“发电厂”的清理。
找到NLRX1后,新的谜题出现:乙酰辅酶A如何向它传递信号?雷群英团队排除“乙酰化修饰”途径,大胆推测两者有直接“对话”。为印证猜想,团队设计“分子钓鱼”实验,用带有生物素标记的乙酰辅酶A作“钓饵”进行“拉拽实验”(pull - down),成功“钓”出NLRX1,证实两者能直接结合。
团队进一步通过放射性配体结合实验,测出两者“亲和力指数”(Kd≈6.6μM)。该指数处于细胞内乙酰辅酶A的生理浓度范围,且在与其他“长相相似”分子竞争中,乙酰辅酶A与NLRX1结合最强。这表明,NLRX1是乙酰辅酶A专属的“接头哨兵”。
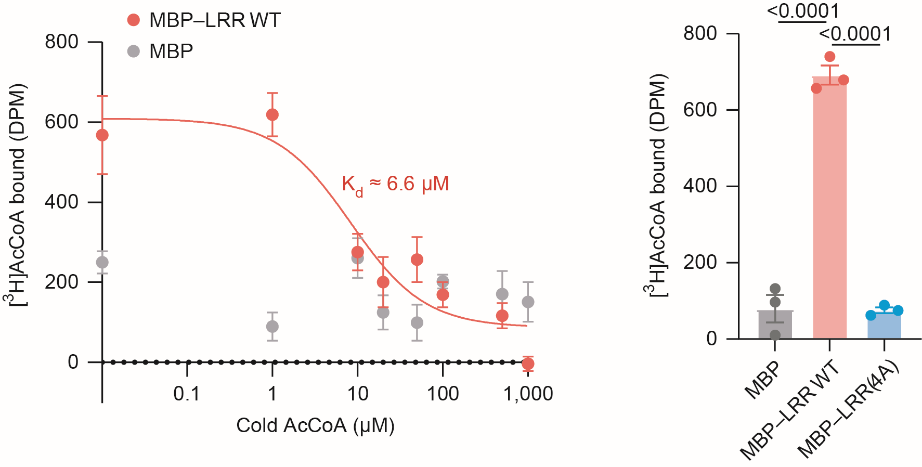
MBP - LRRWT(野生型)与乙酰辅酶A结合Kd值约为6.6µM
将纯化的重组MBP - LRRWT、MBP - LRR(4A)或MBP蛋白与2µM3H标记的乙酰辅酶A共孵育,通过闪烁计数器检测3H标记的乙酰辅酶A结合情况。
基于这些证据,全新信号通路图景呈现:营养充足时,高浓度乙酰辅酶A像“分子刹车”,嵌入NLRX1的LRR结构域,使其“休眠”,阻止线粒体自噬启动。营养匮乏或药物应激时,乙酰辅酶A浓度下降,“刹车”松开,NLRX1改变构象并集结,招募自噬蛋白LC3,启动对问题线粒体的清除。
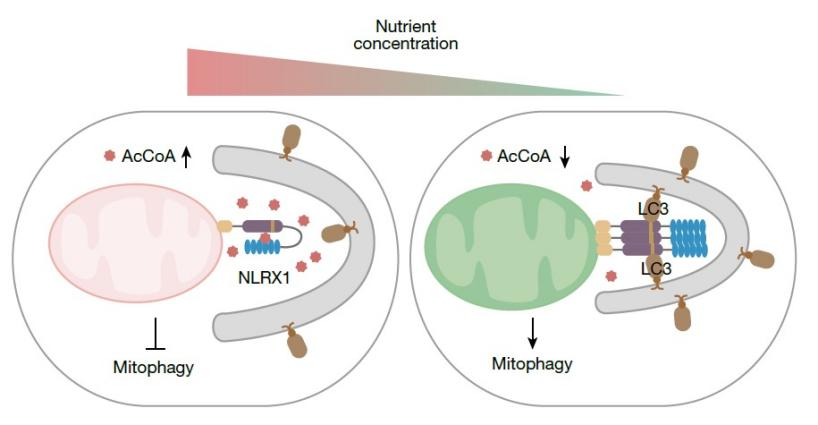
细胞质乙酰辅酶A调控NLRX1的寡聚化和下游LC3自噬小体的招募
在营养充足时,高水平的乙酰辅酶A结合NLRX1的LRR结构域,增强其与NACHT的相互作用,从而掩蔽LIR基序,抑制线粒体自噬。而在饥饿条件下,乙酰辅酶A水平下降,其与NLRX1解离使LIR基序暴露,促进NLRX1寡聚化及与LC3结合,激活线粒体自噬。
为证实这一机制,团队构建了无法结合乙酰辅酶A的NLRX1突变体。结果显示,线粒体自噬在营养充足时也异常活跃,为乙酰辅酶A与NLRX1的相互作用提供了最终证明。
另辟蹊径,多学科交叉攻克临床难题。当基础科学与临床难题相遇,会产生颠覆性成果。雷群英团队的研究就是例证。他们关注KRAS这一常见突变癌基因。虽然KRAS抑制剂为癌症治疗带来希望,但耐药性是临床难题。
团队发现,肿瘤细胞在KRAS抑制剂作用下,启动“自我救护”机制:药物下调ACLY蛋白,使细胞内乙酰辅酶A水平下降,激活以NLRX1为核心的线粒体自噬通路。肿瘤细胞通过清理受损线粒体,减轻药物氧化应激,逃避杀伤、产生耐药。
破解这一机制指明了治疗方向。实验证明,敲除NLRX1或使用线粒体自噬抑制剂Mdivi - 1,能增强KRAS抑制剂的抗肿瘤效果。这意味着,针对“乙酰辅酶A - NLRX1”轴的联合治疗策略,有望克服KRAS突变肿瘤耐药,为癌症患者带来新希望。
这项突破背后是团队跨学科背景的融合与长期坚守。在复旦大学科研平台,团队汇聚多领域人才,从2016年构想,到2018年实验启动,再到2025年成果发表,近十年打磨,过程艰难。
肿瘤研究所博士后沈院和生物医学院研究院23级直博生于承平坦言,研究中膜蛋白纯化是技术瓶颈。NLRX1是膜蛋白,其纯化和共结晶难度高,尝试多种方法、联系多家实验室合作,都未拿到完整晶体结构,论文投稿还因此被拒。
肿瘤研究所2022级博士生汪超为精确捕捉NLRX1的寡聚化状态,查阅文献未找到方案,但他反复尝试优化,最终用温度梯度法在凝胶上分离出清晰条带,为证实机制提供关键证据。
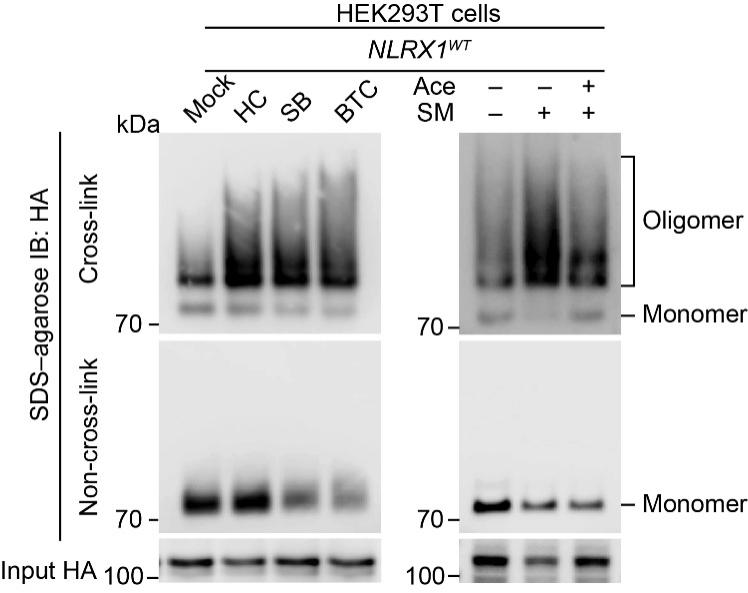
胞质乙酰辅酶A调控NLRX1的寡聚化
团队多学科背景使其能另辟蹊径。肿瘤研究所2020级博士生申晓说,团队成员交流碰撞出很多想法,解决了难题。他们运用多种生化手段,突破技术难题,完成两万余个基因筛选,构建证据链,说服了《自然》期刊审稿专家。

研究团队合影
雷群英表示,学科交叉才能通向科学前沿。正是这种交叉学科精神,推动团队从基础医学创新走向临床转化。
未来,复旦大学将以科技创新为驱动,以人才培养为根本,为解答生命科学难题、攻克重大疾病贡献“复旦智慧”与“复旦力量”。
本文共同第一作者为复旦大学肿瘤研究所助理研究员张一凡、博士生申晓、博士后沈院、博士生汪超;通讯作者为复旦大学基础医学院/肿瘤研究所雷群英教授。研究得到科技部重点基础研发项目、国家自然科学基金委创新群体、腾讯新基石研究员项目等支持。
原文链接:
https://www.nature.com/articles/s41586 - 025 - 09745 - x
来源
医学宣传部
文字
孙芯芸 崔秀琴
图片
受访者提供 宋楠
编辑
邱洁心 黄柳莹
责编
殷梦昊
原标题:《饿一饿更健康?复旦雷群英团队Nature发文揭示原因》
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





