筹资6亿美元,诺贝尔奖团队开发AI制药大模型
网络之父蒂姆·伯纳斯·李曾评价他是“地球上最聪明的人”。
4岁学棋,7岁学编程,16岁考入剑桥计算机科学系,22岁创办游戏公司,30岁重新获得认知神经科学博士学位,然后创办DeepMind,开发AI程序AlphaGo战胜围棋世界冠军,开发AlphaFold解决蛋白质结构预测难题,并获得2024年诺贝尔化学奖,成为全球AI领域第一人。

Demis IsomorphicHassabis图源 官网的Labs
对Demis来说 就Hassabis而言,他有着丰富的生活经验和显著的成就。在2021年,他把目光转向了医学研发领域,创立了Isomorphic。 Labs,依托AlphaFold的技术成果,Hassabis是一家专注于AI药物研发的创业公司。Hassabis希望通过人工智能改善药物研发过程,促进生物医学领域的发展。
自成立以来,Isomorphic Labs开发了多种新一代AI模型,它们组成了一个统一的AI药物设计引擎,可以应用于多种治疗领域和药物方法。最近,Isomorphic 通过Thrivee,Labs宣布获得6亿美元融资。 Capital领先,GV和Alphabet参与投资,将用于进一步开发下一代AI药物设计引擎,促进治疗进入临床阶段。
从AlphaGo,到AlphaFold,再到AI药物设计引擎
Demis AI逐梦之旅Hassabis源于童年。
早期接触和学习围棋的经验培养了他的战略思维能力,也为他以后在AI领域的深度培养奠定了独特的思维基础。Hassabis系统学习了剑桥大学计算机科学专业的理论知识。毕业后短暂投身游戏行业,开发AI模拟游戏。这种实践经验使他深刻认识到人工智能在模拟人类学习能力方面的潜力,同时也坚定了他创造“自主学习”AI的想法。
Hassabis于2010年创立了DeepMind,开始了一段将想法转化为现实的旅程。DeepMind于2016年开发的AlphaGo是4:1战胜围棋世界冠军李世石,这场人机游戏的胜利,不仅仅是技术上的突破,更让全世界看到了AI在复杂战略领域的无限可能。AlphaGo在Hassabis看来并不是人们认为的“机器”:AlphaGo就像和人类一起探索宇宙的哈勃眼镜,就像和我们一起探索围棋的哈勃一样。
此后,Hassabis带领团队将目光投向了医疗领域。DeepMind基于与英国医疗行业合作获得的数据,推出了DeepMind。 Health智能医疗系统,为诊断和症状判断提供AI协助。
AlphaFold在2018年被称为“蛋白质结构预测奥运会”的CASP(Critical Assessment of Structure Prediction)在比赛中,97名选手获得冠军,并根据基因序列成功预测蛋白质的3D结构。这一结果不仅解决了困扰生物学半个世纪的难题,也为医疗领域的变革和新药研发奠定了理论依据,使Hassabis团队在2024年获得诺贝尔化学奖。

2024年,Hassabis团队获得诺贝尔化学奖
2021年,凭借AlphaFold的技术积累,Isomorphic Labs宣布成立。Hassabis作为一家脱离谷歌DeepMind的子公司,承载着利用人工智能改革药物研发的新目标。
Isomorphic 首席AI官MaxLabs 在采访中,Jaderberg提到,药物研发的本质是在近乎无限的分子空间中找到最优解(科学家估计大约有10^60个概率,远远超过宇宙原子数量)。Isomorphic 利用AI技术,Labs的目标是建立一个AI药物设计系统,更有效地筛选和设计药物分子。
2024年至今,Isomorphic Labs迎来了许多关键的发展节点:
1月份,公司与诺华、礼来达成战略合作,分别获得3750万美元和4500万美元的预付款,用于共同开展AI协助药物研发。其中,与诺华的最初合作侧重于针对三个高难度靶点的小分子治疗,而与礼来的合作侧重于几个未开放的靶点的小分子药物研发。
5月,lsomorphic AlphaFold与谷歌DeepMind联合发布 该模型不仅可以预测蛋白质折叠,而且可以准确地分析药物中常见分子的相互作用,大大提高药物研发效率。
2025年2月,诺华宣布扩大与Isomorphic 在原有三个目标的基础上,Labs的合作范围最多可以增加三个研究项目。Fiona诺华生物医学研究总裁 在过去的一年里,Marshall提到了Isomorphicl。 Labs的AI技术已经帮助探索了传统方法无法触及的新化学空间。未来,双方将继续聚焦高难度靶点,满足未满足临床需求的患者。
目前,Isomorphic 以统一的AI药物设计引擎为核心,Labs不断开发新的预测和生成AI模型,聚焦肿瘤学和免疫学领域,通过分析生物数据挖掘药物备选分子,为全球患者带来创新的治疗方法。
高度精确的分子预测能力,覆盖各种生物领域
在生命科学研究领域,蛋白质结构分析是了解生命活动分子机制的重要环节,可以为药物设计提供关键依据。过去,蛋白质结构分析主要依靠X射线晶体、磁共振、冷冻电子显微镜等实验方法。虽然这些方法可以提供高性能的蛋白质结构信息,但通常需要花费大量的时间和精力,这是有限的。
2020年,AlphaFold 2利用深度学习算法实现重大进步,三维结构只能通过蛋白质的氨基酸序列准确预测,为后续研究提供核心技术支撑。自发布以来,AlphaFold 2广泛应用于全球科研领域。数百万研究人员将其应用于疟疾疫苗研发、癌症靶向治疗探索、工业酶优化设计等多个方向,并获得了许多权威荣誉,如生命科学突破奖。
AlphaFold2024年推出 3完成了技术的进一步飞跃:
改进Evoformer核心模块。Evoformer是一种基于深度学习的结构,受Transformer模型(类似于ChatGPT的关键结构)的启发。通过对序列数据的深入分析,可以有效地处理输入分子信息,捕捉分子之间复杂的进化关系和相互作用。
分子3D结构的扩散网络。AlphaFold 3序列数据处理完成后,分子结构通过扩散网络生成。这个过程类似于AI图像生成技术。从模糊的原子云状态开始,经过数百次甚至数千次的迭代优化,模型不断优化原子位置和相互关系,逐渐收敛到能量最低、物理规律更加精确的3D结构。
由单一蛋白质到全类生物分子。与AlphaFold相比, 2仅对蛋白质结构进行预测,AlphaFold 3完成跨分子类型预测,其范围涵盖DNA、RNA、所有类别的生物分子,如配体。多种分子共同完成生物体内的功能,例如基因表达需要DNA。、RNA、共同参与蛋白质,AlphaFold 3分析了细胞中更多种类的生物分子的结构和相互作用,为全面了解生物系统的复杂性提供了更强大的工具。
预测分子相互作用的精度突破。就蛋白质与其它分子相互作用的预测精度而言,AlphaFold 与传统方法相比,3至少提高了50%,部分关键场景的精度翻了一番。这使得科学家能够更准确地理解生物分子之间的相互作用,对药物设计和疾病机制的理解具有重要意义。由于精确的分子相互作用信息是开发有效药物和深入研究疾病发生和发展过程的关键。
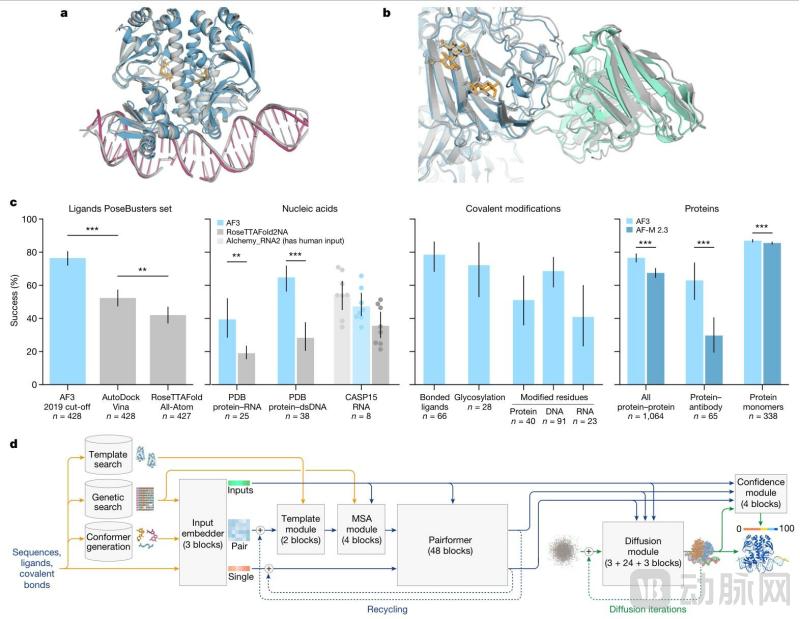
AlphaFold 三是对生物分子复合物结构的准确预测。
假设AlphaFold Isomorphic是AI制药领域的基础科学突破, Labs的AI药物设计引擎就是这个突破性的工业应用案例。它的发动机是AlphaFold 三是以扩散模式、多任务加强学习框架等多种前沿AI技术为核心技术支撑,形成有机协同的整体框架。
其中,扩散模型可以根据已知的分子结构生成具有潜在活性的分子,通过分析和转换现有的分子结构,创造出可能具有药用价值的新分子,丰富可选药品库;根据药物研发的需要,动态优化模型参数,实现从预测分子结构到优化设计的完整技术链。
在传统药物研发过程中,选择备选药物分子是一项费时费力的工作,通常需要多年甚至几十年的时间进行大量的实验和计算。isomorphic 借助AI技术,Labs的AI药物设计引擎可以在短时间内处理大量的生物数据,并通过智能算法快速识别潜在的药物备选分子,从过去的平均值中获得5个~10年降到1~在药物研发效率上,两年甚至更短,实现了质的飞跃。
当前,发动机在药物研发方面表现出三大核心优势:
技术层面,AlphaFold 3高精度分子预测能力可以预测生命分子的所有结构和相互作用,从而准确分析药物与靶点的结合,为药物设计提供更准确的分子结构信息,使R&D人员能够基于对分子机制的深刻理解来设计药物,显著提高药物设计的通过率。
效率方面,引擎取代了人工实验和数据处理,可以有效识别有前途的药物备选分子,从而缩短药物发现周期,降低研发成本,加快创新药物的推出,为患者提供更快的有效治疗方法。
应用方面,由于技术瓶颈,传统药物研发通常受到疾病领域和药物类型的限制,而发动机可以同时探索肿瘤、免疫疾病、罕见病等多个领域,以及小分子、生物制品等多种药物方法,对药物设计的关键层面有很强的预测,如配体结合、复合体稳定性等,大大拓展了药物研发的边界。
六亿融资,只是一个开始。
近几年,在生物医学领域,AI 技术正在发挥越来越重要的作用。
根据《2025年AI制药市场分析及未来发展趋势报告》,预计2025年全球AI制药市场规模将达到200亿美元,复合增长率将超过30%。在AI制药领域,全球有100多家创业公司和大型制药公司投入了大量资源进行研发。
在Max 在Jaderberg看来,未来十年将是药物研发的转型期。伴随着人工智能技术的发展,生物领域正迎来“GPT-“3时”-AI模型将从被动模拟转变为主动创造,产生具有自主探索能力的“科学智能体”,而AI模型则是 随着靶向药物、合成生物学的普及,蛋白质作为药业的主要支系越来越受到重视。
使用AlphaFold 以3为代表,动态结构模拟技术创造了一个新的研发层面——药物设计不再局限于静态分子结构,而是聚焦于溶液中蛋白质的真实运动状态及其与药物的相互作用,这将显著提高备选药物的有效性。
伴随着技术的突破,正在使用大量的蛋白质预测数据库和设计工具。Meta的结构数据库公开了大约2亿个蛋白质结构模型。esm-免费提供超过6亿次蛋白质三维结构数据的fold软件。就设计工具而言,RoseTTA Fold、AlphaFold 三是全新的国际蛋白质数据库PDB服务,都是相关研究提供帮助。
与此同时,AI的应用在药物发现方面取得了显著成效。例如,斯坦福医学院和麦克马斯特大学的研究人员开发了SyntheMol模型,并成功生产出能够抑制超级细菌鲍曼不动杆菌的分子。英硅智能利用自主研发的AI平台,成功识别罕见肺病的全新药物靶点,整合多源数据,探索疾病分子关系,为新药研究开辟新路径。
然而,AI制药的发展仍然面临许多挑战。虽然技术突破带来了希望,但实际落地仍然需要跨越许多障碍,如数据、控制和行业合作。然而,不可否认的是,AI正在从医疗研发的辅助工具转变为重要的驱动力。
目前,AI 技术几乎涵盖了从药物靶点发现到临床研究的全链条阶段。随着技术的深入应用,人类对各种药物的快速研发和突破疑难疾病的愿景逐渐接近现实,而Isomorphic Labs正站在这一变革的前沿。
本文来自微信微信官方账号“动脉网”(ID:vcbeat),作者:陈茂雨,36氪经授权发布。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





