中国创新药物:十年破壁,深海突破
编者按:
创新制药行业正在迎来政策支持、产业升级和业绩复苏的“三重共振”。随着金融市场估值逻辑的加快重构,传统的评估方法已经难以适用。21 世纪经济报道将继续聚焦行业热点——从 BD 从高估值背后的风险到政策起伏的应对,从交易模式到全球竞争策略,推出了一系列报道,深入解读了创新药企如何在变革中穿越周期,重塑价值坐标,定义行业新未来。
凌晨两点,波士顿海港区会议中心,落地窗外的大西洋漆黑如墨。
王黎的指尖不自觉地穿过冰冷的玻璃,后面的团队正在为几个小时后决定企业命运的谈判做出最后的冲刺。中国 Biotech 公司的 CEO 深信,他手中经过五年打磨的免疫肿瘤药物数据,将会到达。 2025 每年都会打开欧美市场的大门。
2025 2008年是中国创新药“出海”爆发的一年。
回顾十几年前,中国制药行业主要以仿制药为主。然而,短短十年时间,中国创新药物实现了从 me-too(模仿药物)到 fast-follow(快速跟进开发药品) first-in-class(同类首创药物)华丽转身,逐渐攀登至“ DeepSeek 瞬间,推动众多创新药企进入价值重塑的新篇章。
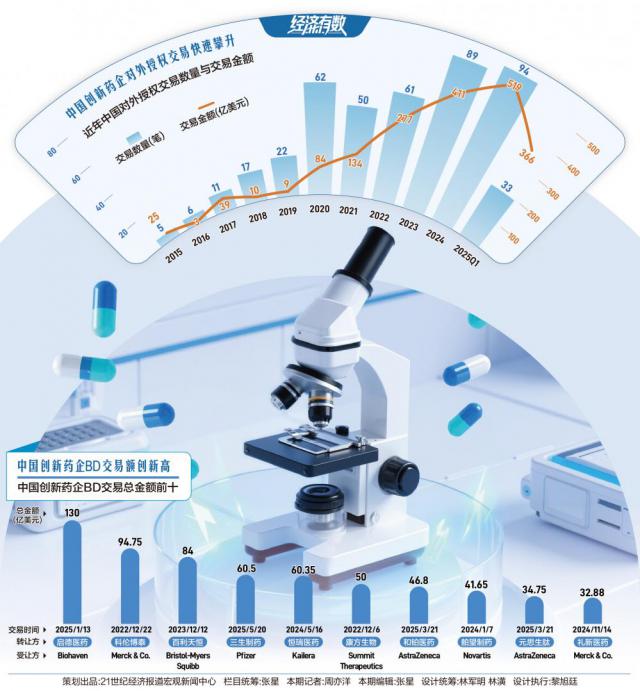
有几组不断发展的行业数据可以作为证明: 2025 2008年美国临床肿瘤学会(ASCO)中国学者在年会上有 73 本研究选择了口头报告阶段,创造了亚洲中国的记录; 1~5 月,国家美国食品药品监督管理局累计许可。 20 余款 1 类创新药上市,刷新近五年同期记录;今年中国创新药企对外授权(license-out)总交易量已经达到 455 亿美金,而 2024 这个数据是全年的 519 亿美金。
聚焦于 license-out,这是跨国制药公司用实际行动为中国创新药物投票的信任票。据很多业内人士透露, license-out 在商业发展战略中,跨国制药公司可以在管道补充后有效改善专利悬崖带来的压力,而创新制药公司可以在R&D阶段实现资金回流,从而在全球市场建立品牌声誉,为市场奠定坚实基础。
但就在七年前,在波士顿,一个半夜打来的电话打破了王黎的幻想——当中国制药公司冲向世界时,国际监管部门冰冷的质疑往往成为第一道致命的冰墙。
冰冻航道
2018 2008年冬天,时尚担任跨国制药公司R&D骨干的王黎收到了国内一家新兴生物技术公司创始人的海洋电话。电话那头声音嘶哑:“ FDA(美国美国食品药品监督管理局)拒绝安排会议...他们说实验设计不符合国家标准。”
这种情况并非孤立。当中国药企带着创新药独闯深海时,却在三个暗礁前连续触底:
临床试验设计就像故步自封一样。一个明星抗癌药的第一期数据令人惊叹,但是 FDA 审查中有很多瑕疵。“不是数据本身不好”,一个曾经深度参与初始项目的人。 CRO(合同研究机构)负责人回忆说,“我们对游戏规则一无所知,不清楚。 FDA 评审者真正关心的是什么,疑问的是什么。
专利性布局更是致命伤害。明星抗肿瘤药物 License-out 谈判临门一脚时,国际大厂突然亮出杀手锏——核心化合物专利存在区域保护漏洞,交易瞬间冻结。“从项目成立之初,企业是否以全球市场为目标,建立了贯穿整个药品生命周期的全球知识产权战略思想?很多项目在早期是‘发明’而不是‘布局’。”王黎的话被戳破了。
资本寒流周期性肆虐。2018~2019 年冬时节,无数人手握优质R&D管道。 Biotech(生物技术公司)倒在黎明前。"资本只想赚快钱,"王黎叹了口气,"没人想等十年磨一剑。"
回顾过去十年中国医药行业最显著的变化之一,就是从“以仿药为主”到“以原药为主”。这不仅是政策驱动的结果,也是资本驱动、R&D人才回流、临床需求爆发等多种因素共振形成的科技革命。
2015 几年前,中国药品市场被“带金销售”困住。新药审批缓慢,质量标准滞后,自主创新乏力,整个工业生态陷入了“低质量内卷”的泥潭。2015 年," 722 考试飓风已经成为转折点,随着中国药品审查改革的开始。审批速度加快,质量标准符合国际标准,临床数据真实性提高。这一轮改革,为原创新药研发开辟了政策渠道,也激发了资本和人才涌入医药行业的热情。
两年后,中国创新药的第一年正式开始。王黎回忆说:“那一刻,似乎大门大开,资本如潮水般涌入。海归科学家纷纷回国创业,创业公司如雨后春笋般涌现。”
然而,这一波“创新药热”很快带来了另一个问题——同质化严重,竞争无序加剧。一种癌症免疫治疗药物 PD-1 单抗市场无序竞争的“卷”已经达到了一个新的高度:短短几年时间,国内申请临床 PD-1 产品数十种,上市后价格战也迅速拉响。
“起初,我们认为创新意味着创新。 first-in-class 但是后来才意识到,first-in-class 只是起点,能否实现商业价值才是核心。”王黎说。
当王黎 2020 年决心放弃跨国制药公司“金饭碗”自立门户时,行业内的“创新药”变成了黑色幽默:几十家制药公司聚集在一起。 PD-1 跑道,价格战太激烈了,一瓶茅台不如一瓶注射剂。
破冰利器
困境迫使改变。三重缺失催生了一个非常重要的系统重构,即静水深流。
首当其冲的是临床研发。成立王黎公司的第一件事,就是巨资挖来之前。 FDA 评价专家坐镇。当 2023 2008年,国家美国食品药品监督管理局跻身 ICH(国际药品注册技术协调会)管理委员会,头部药企早已将国际标准刻入基因。“这个不是点缀,而是生存之道。"王黎指出,目前国内头部制药公司已建立了强大的国际临床运营团队, ICH 指南融入血液。中国研究人员发起的多中心研究质量开始得到国际期刊和监管机构的认可,数据管理、统计分析的标准化水平大幅提高。
严格遵守国际标准,是时代所需要的。
同时,专利对决也悄然升级。
早在几十年前,跨国巨头的专利律师就已经嵌入了R&D的全过程,从目标选择上编织了全球专利网络。战略从单一的化合物保护扩展到全方位、多层次的“专利丛林”建设,如晶型、用途、组合物和制备技术。
一位服务于多家头部药企的顶级知识产权律师透露:“现在不要等到发明出来再申请专利,而是在项目启动会上,IP 战略与R&D战略和市场战略同步讨论。我们需要提前洞察竞争对手未来十年可能采取的行动路线,提前部署“障碍”,以阻碍其进程。"
专利权,真正成为后续创新药出海航船的压舱石和矛尖。
王黎把过去在跨国制药公司的工作经历带到了中国,进一步将创新药战场聚焦在知识产权的战场上,从被动防御转变为主动布局。
也是在 2020 2008年,资本逻辑完全重写。港交所 18A 撕开与科技创新板第五套标准的裂口,2020 年 14 家未盈利 Biotech 登陆港股创造亮点时刻。专业医疗基金开始深度培育长期,“烧钱游戏”转变为“造血竞赛”。
变革最终在 2025 火星年爆发:前 5 个月 NMPA 准许 20 余款 1 类药,创五年新高;ASCO 年会上中国 73 本研究选择口头报告,登顶亚洲。创新药业表现强劲,多家创新药企股价大幅上涨。
深海暗涌
当 License-out 成交额从 2015 年 5 笔 25 亿美元,飙升至 2024 年 94 笔 519 十亿美元,狂欢背后的暗潮涌动:
74% 香港制药公司仍然挤在肿瘤跑道上,HER2、PD-1 等待目标重复建设严重。歌曲制药连续停止 ASC42、ASC06 管道,暴露研究开发失焦慢性疾病。
资本过热导致估值泡沫。一家企业凭借一期临床数据市值突破数百亿,三年后股价“脚踝斩”。2025 年 6 月亮,还有铂药 580% 与德琪医药相比,涨幅更大 500% 在飙升的背后,更多的是 18A 在三期临床终点之前,企业无法实现。
BD 交易存在价值争议。三生制药双抗药 60.5 一亿美元授权辉瑞创纪录,却被质疑“卖青苗”;恒瑞药业靠 IDEAYA 的 7500 万美元首付承担季度利润,引发“借外拐棍”争议。
BD 这是近年来中国创新药领域的一个热门词汇, BD,也就是商业发展,在医药领域主要是指公司通过 License-in、License-out、并购等多种形式,实现战略合作、资源整合,实现利益最大化。
在 BD 在合作模式下,市场普遍关注的是 License-out,也就是说,创新制药公司将授权其他制药公司在后期进行自主研发管道的临床和商业化。根据最新数据,中国已经成为全球 License-out 一个最活跃的交易区域。
尽管整体形势朝气蓬勃,但关于整体形势, BD 交易争议总是存在的,有些人会 License-out 与“销售未成熟水果”相比,有些人认为某些产品的估值“过于保守”。
“是否廉价出售取决于三把尺子。”高特佳投资集团副总经理王海蛟指出,“管道的后续进展、跨国制药公司的风险水平和竞争格局的变化共同决定了交易的质量。”
换句话说,如果“卖青苗”的策略可以促进企业其他研究项目的发展,企业可以获得新的生活,那么这个策略是值得肯定的。但也不排除有些公司可能会用这笔资金来启动新项目,最终可能导致失败。因此,在采用“卖青苗”战略的前夕,企业必须全面细致地评估潜在风险。
虽然“卖青苗”的争议还在,但一个不争的事实是,当创新不再是纸上谈兵,当“中国R&D”开始走向世界,属于中国创新药物的时代,正在到来。
破冰远航
在凌晨的波士顿会议室里,王黎像珠炮一样询问跨国巨头。屏幕闪烁着他紧绷的脸庞,全球多中心临床试验的数据流像星图一样闪烁——每个斑点代表着不同大陆的受试者。
数据背后,是中国临床团队无数个日日夜夜的严谨操作,是专利团队对国际规则的灵活运用,是资本在漫长寒冬中从未熄灭的信任之火。
当对方最后表示“基于现有数据,我们同意这种药物在目标群体中显著受益,具有临床表现,其安全特征是可以接受的。建议进入下一阶段。”谨慎掌声。
窗外大西洋的墨色正在被黎明刺穿。这种光线虽然微弱,但却是坚定的。王黎知道,这只是漫长航程中关键航段的通过。前方是一片更广阔、更具挑战性的深海。
此时此刻,中国制药公司的航海图正在重绘:2024 2008年,大约有跨国药企引进的创新药物备选分子。 31% 起源于中国;今年年初 43 届 J.P. 在摩根医疗健康会议上,美国食品药品监督管理局前厅长 Scott Gottlieb(斯科特 · 戈特利布)透露,2024 年 FDA 批准的 IND(新药临床试验申请)分子中,超过 50% 分子来自中国;数据显示,中国创新药企正在 BD 合作中的份额已经从过去的份额中获得。 5%~10% 提升至 15%~20%,充分体现了国内创新药物技术溢价能力的显著提升。
虽然出国很重要,但实现“最大价值”是中国创新药企的核心追求。中国创新药企如何通过? BD 交易,实现从“R&D强”到“变现强”的转变?
" BD 不是买卖,而是战略价值交换。“王黎总结了五年的经验。他不仅追求交易数字,还追求交易数字。 BD 访问全球临床资源网络,使每一次授权都成为能力越迁的跳板。
对他来说,成功 BD 交易需要满足三个核心要素:一是独特的产品价值,即非“ me-too "商品,而是" first-in-class "或" best-in-class "(同类最佳)创新药;第二,全球权益结构明确,包括专利、数据和商业化权等,确保资产“可交易”和“可估值”;第三,强大的临床和注册能力,能为国际多中心提供高质量的临床资料,为世界注册申报提供有力支持。
更深层次的,是怎样通过的? BD 交易,反馈企业自身的R&D和商业化能力。“我们想要的不是一次性交易,而是全球‘朋友圈’。”王黎说,“通过 BD,我们可以访问国际顶级的临床资源、注册资源和商业资源,这将加速我们的R&D和全球布局。"
资深投资者在国内生命医疗大健康领域,Pivotal bioVenture 管理者柳丹告诉记者,在全球生物医药产业链中,对外授权已成为一种常态化的商业模式。对于大多数处于成长期的中国创新制药公司来说,他们目前没有控制药物研发、临床试验、注册审核、全球销售等全链条的能力。通过对外授权,可以看作是中国创新制药公司现阶段借船出海的“妙方”。
正如一位资深投资者所总结的,只有在研发、临床、IPO、在资本、商业化等各个环节形成闭环,中国创新药物才能真正具有全球竞争力。
晨光正在撕开海雾,王黎团队走出会议室。
在港交所,映恩生物 IPO 获得 14.9 超额认购的倍国际配售,投资者的目光已经从故事转变为临床进步和变现能力。
2025 年初夏,中国创新药企在资本市场总市值上突破万亿关口。那些曾经聚集在一起的人。 PD-1 今天的玩家 ADC、双抗性、细胞治疗管道全面开花;曾经被诟病“裸奔专利”的企业,开始用全球专利网守护创新果实。
晨光中的大西洋波光粼粼,冰川还伏伏在海平面下。然而,破冰船已经驶离港湾,航向浩瀚的星星——每一个闪烁的临床试验数据点,都是无数中国科学家、企业家和投资者在深海中刻度了十年的航标。
真正的挑战不在于飓风来临时,而在于船队穿越飓风后,是否还记得为什么要开始。
2025 2008年,只是一个开始。中国创新药物的浩瀚星辰,才刚刚起航。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





