这所学校,同一天的“细胞” 2!
原创 喜爱科研的 浙江大学
四月二十四日,北京时间
《细胞》是国际顶级刊物
浙江大学团队又发布了两项重磅研究成果
大家一起来看看吧!
︎浙江大学医学院徐浩新教授团队对非经典溶酶体氢离子泄漏方式的分子基础-SLC7A11进行了鉴定,并揭示了该通道参与溶酶体和细胞功能调节的机制,以及其在神经退行性疾病病理过程中的关键作用,标题为“SLC7A11” is an unconventional H transporter in lysosomes"研究论文。徐浩新和浙江大学医学院胡美钦研究员是共同的通讯作者,浙江大学医学院博士生周南、陈静芝和胡美钦是共同的第一作者。
︎ 浙江大学医学院胡海岚教授团队揭示了外缰核和蓝斑核在压力压力下的循环接力,以及神经元和星形胶质细胞的时序激活,传递压力信息,介绍抑郁症的发生,展示了不同细胞群体共同参与情绪编码的场景,从分子、细胞和神经环路水平上解释了“压力大”导致抑郁的原因。标题为“发表”Neuron-astrocyte Coupling in Lateral Habenula Mediates Depressive-like Behaviors"研究论文。作为通讯作者,胡海岚是浙江大学医学院博士生辛倩倩,王俊盈是第一位作者。
浙江大学医学院以领先成果为核心,服务国家重大战略,激励原创自由探索,深化“有计划科研”创新范式,不断整合跨学科资源,努力打通“临床需求牵引-基础理论突破-前沿技术转型”全链条,建立相互欣赏、相互成就的学术生态。2025年3-4月,学院在复发难治性肝癌、冠心病、中风、帕金森病等临床疾病的机制研究、大脑心理现象的动态机制、抑郁症的新机制等领域,继续在《细胞》、《自然》、《柳叶刀》等顶级期刊上发布6项突破性成果,突出有计划的科研与自由探索相结合的澎湃动能,向世界呈现浙江大学医学勇攀科技巅峰的硬核实力。
氢离子溶解酶体的“慢出口”

氢离子释放和“新出口”?
溶解酶是细胞的“废物回收中心”,通过自噬过程将细胞本身损伤细胞器等“废物”降解再利用。pH值保持在溶解酶体内。 4.5-5.0的酸性环境还含有多种酸性水解酶,有助于降解“垃圾”,其中酸性或过碱会明显抑制其中酸性水解酶的活性,导致细胞中降解物沉积和自噬受阻。与帕金森病、阿尔兹海默病等神经退行性疾病密切相关的溶酶体功能问题。
溶酶体膜上的氢离子泵V-ATPase将继续从细胞质向溶酶体“泵注”氢离子,以保持适当的酸性环境。“溶解酶体内部的稳定状态取决于‘一进一出’的平衡,就像水库保持水位一样。如果有进水泵,必须配备出水闸。溶解酶体膜上还应有明确的离子通道介导氢离子流出。”徐浩新说,该团队在2022年确定了溶酶体第一个氢离子通道TMEM175。它是一种氢离子释放的“紧急快速出口”,在溶酶体环境偏酸时被激活,介导氢离子快速流出。
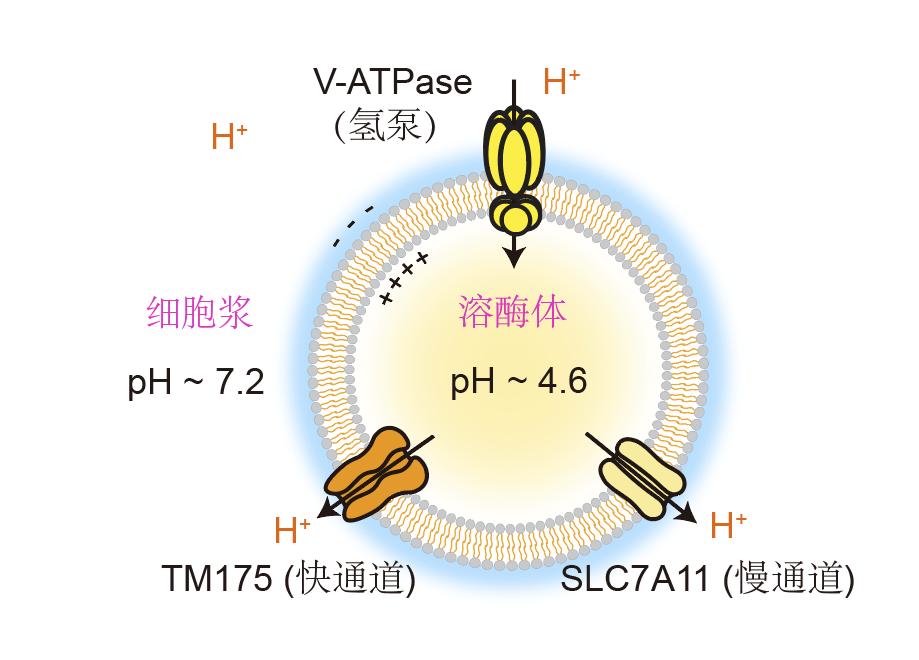
但团队发现,当已知的氢离子“进出口”全部关闭时,溶酶体仍在逐渐碱化,同时敲除细胞中氢离子通道TMEM175,抑制氢离子泵V-ATPase的功效,即氢离子的“进出口”全部关闭。“这表明氢离子泄漏或释放方式尚未被发现。”胡美钦说。
于是,团队开始寻找氢离子的“慢出口”。
坚定自己的判断
为了找到这条未知的路径,团队建立了OLMP敲除细胞库,其中含有约60种溶酶体膜蛋白,基于大量公开发布的溶酶体蛋白组学数据,从中筛选出去酸化的关键蛋白——SLC7A11。
“在检测SLC7A11介导的离子转运时,我们首先尝试使用了团队的独特技能——溶酶膜片钳技术,但没有记录明显的电流。”周南表示,团队猜测SLC7A11作为转运蛋白(转运速度远低于通道蛋白)介导的离子流量可能低于膜片钳的检测限制。因此,团队再次探索实验方案,开发了一套新的监测方法,通过特异性分离纯化酶体,然后采用显像试验,观察慢离子流动。

同时,小分子化合物库高通量筛选试验还发现,小分子化合物库高通量筛选试验显著增强了溶酶体的酸性。——Erastin。Erastin是一种常见的铁死诱导剂,其目标是SLC7A11。
研究人员认为,SLC7A11主要定位于细胞膜上,这是以前的研究和报道。 陈静芝表示,在超分辨率荧光显微镜下,球队可以清楚地看到溶酶体膜上大量细胞的信号。
面对这种现实与前人经验的矛盾,团队坚定了自己的判断力,做了大量的实验,确定了SLC7A11主要定位在溶酶体上,通过顺浓度梯度排出胱氨酸,摄入谷氨酸,发挥氢离子流出和酸性调节的作用。
作为酸性氨基酸,谷氨酸的侧链pKa约为4.3,在溶酶体酸性环境中以质子化的形式存在,但在细胞浆中性环境中以质子解离的形式存在。它是一种非典型的溶酶体氢离子泄漏通道,因为它是一种非典型的溶酶体氢离子泄漏通道,因为溶酶体跨膜转运通过其质子化/氢离子解离形式持续向胞质运输氢离子。”胡美钦说,这项研究还填补和扩大了SLC7A11蛋白在溶酶体上的研究空缺。
治疗疾病的新希望
另外,团队发现,SLC7A11失活后溶酶过度酸化,导致水解酶活性明显下降,大量待降解基物堆积。病理性表现在神经元中α-突触核蛋白的汇聚。他说:“这些结果已经验证了早期帕金森病患者的细胞模型,他们携带了SLC7A11突变。”胡美钦说,SLC7A11是帕金森病的一种新型风险基因,将来可用于疾病的早期筛查和新的治疗。
周南表示:“我们使用低浓度小分子药物氯喹将过酸化的溶酶体pH值调整到正常范围后,意外发现铁死亡过程得到有效抑制。“这提醒溶酶体酸碱失衡可能是铁死亡的关键原因。”

"SLC7A11介导的溶酶体慢速氢离子泄漏模式,结合我们之前发现的TMEM175介导的溶酶体快速氢离子释放模式,‘一慢一快’和氢离子泵V-ATPase构成了溶酶体酸碱调节的逻辑闭环."徐浩新说,这为团队的研究填补了一个空缺。
为什么压力会导致抑郁?
锁定“压力电台”,听三群脑细胞“对话”
结束紧张的考试,写一份棘手的报告,当你坐下来听音乐放松的时候,你的大脑其实还处于压力之中——你在日常生活中会遇到各种各样的压力,当压力消除的时候,大脑的压力不会马上停止。就像在平静的湖面上投入一块石头,花了一段时间才逐渐消失。
胡海岚团队通过跟踪大脑中压力的“波澜”,发现大脑中有一个“压力电台”,它有三个“主播”坐在镇上:外面的缰核。(LHb)神经元,蓝斑核(LC)去甲肾上腺素能神经元和LHb星形胶质细胞。当压力来临时,三位“主播”跨脑区联动“播放”压力信息。在LHb星形胶质细胞的帮助下,短期的压力刺激转化为持续时间较长的神经元活动。这一独特的反应机制为长期压力积累引发抑郁情绪埋下了隐患。

星星在闪烁
缰核(Habenula)这是脊椎动物大脑中的“标准”核团。这些都是外侧缰核(LHb)被称为“反奖励中心”,当我们遇到压力、恐惧、挫折时,这个大脑区域就会被激活,参与负面情绪的编码。胡海岚研究小组在这里跟踪压力的传播轨迹时,决定观察一个奇怪的“风景”——星形胶质细胞。胡海岚说:“过去关于LHb的研究主要集中在神经元,而星形胶质细胞却很少被注意到。我们仍然知道他们在做什么,如何与神经元互动。”
在人脑中,星形胶质细胞约占脑细胞总量的40%。起初,人们认为它们就像“胶水”,只是为神经元提供保护和支撑,而不是参与大脑的复杂功能。直到最近30年,这个大脑中的“小萌新”才引起了科学界的关注,它们的“隐藏技能”也相继被挖掘出来,比如调节神经元突触发育,调节神经元的可塑性。
当星形胶质细胞工作时,细胞中的钙离子浓度会发生显著变化,因此我们可以通过钙离子信号来判断它们的声音。然而,LHb是一个小而致密的核团,从来没有人观察过这个大脑区域的星形胶质细胞。研究人员探索了各种病毒工具的显像参数,终于从嘈杂的信息中清晰地显示出钙信号。
他们就像夜空中闪烁的星星。博士生辛倩倩记得他第一次看到信号时的兴奋。“星形胶质细胞不是‘沉默’的,相反,它们仍然非常活跃!” 博士生王俊盈介绍了这篇论文的第一作者,他们同时监测了多个大脑区域星形胶质细胞的声音。当步行中的老鼠遭受脚底麻木时,LHb星形胶质细胞反应最快,这是大脑中第一个承受压力的星形胶质细胞。
三个细胞一个“戏”
在人类社会中,频繁持续的压力是抑郁症最常见的诱因。2018年,胡海岚团队在Nature上发表了一项工作,指出抑郁样行为来自大脑LHb神经元的簇状放电。但是当时他们不知道为什么这些神经元出现了异常。于是团队决定追溯:最初的压力对神经元做了什么?星形胶质细胞是否参与?
研究小组制定了临床试验,用1秒钟的随机脚底电击给老鼠施加压力,然后“听”了LHb的脑细胞。:第一波神经元信号传来,间隔一秒后,星形胶质细胞信号紧随其后。他说:“这提醒前者可能参与主导后者的活动,但是滞后反应的星形胶质细胞对以前的神经元活动有什么影响?“胡海岚的问题让辛倩倩突然意识到,她应该在更长的时间内观察神经元的活动:“我们发现第一次强烈激活后,LHb神经元实际上有第二次激活。”辛倩倩说,当他们把观察时间从5秒延长到50秒时,他们看到了这种从未被报道过的“神经余震”。虽然信号较弱,但持续时间较长。
对话记录显示,星形胶质细胞的信号正好卡在神经元的两个活动之间。正当研究团队想要“审结”这一点,将压力应激描述为LHb内神经元与星形胶质细胞的互动时,实验阶段出现了意外:在离体脑片实验中,LHb的神经元无法“唤起”星形胶质细胞。另一个“人”激活LHb胶质细胞?在“压力对话”中,这次意外迁移了另一位主角——蓝斑核(LC)去甲肾上腺素能神经元,其“特产”去甲肾上腺素是激活LHb星形胶质细胞的幕后推手。
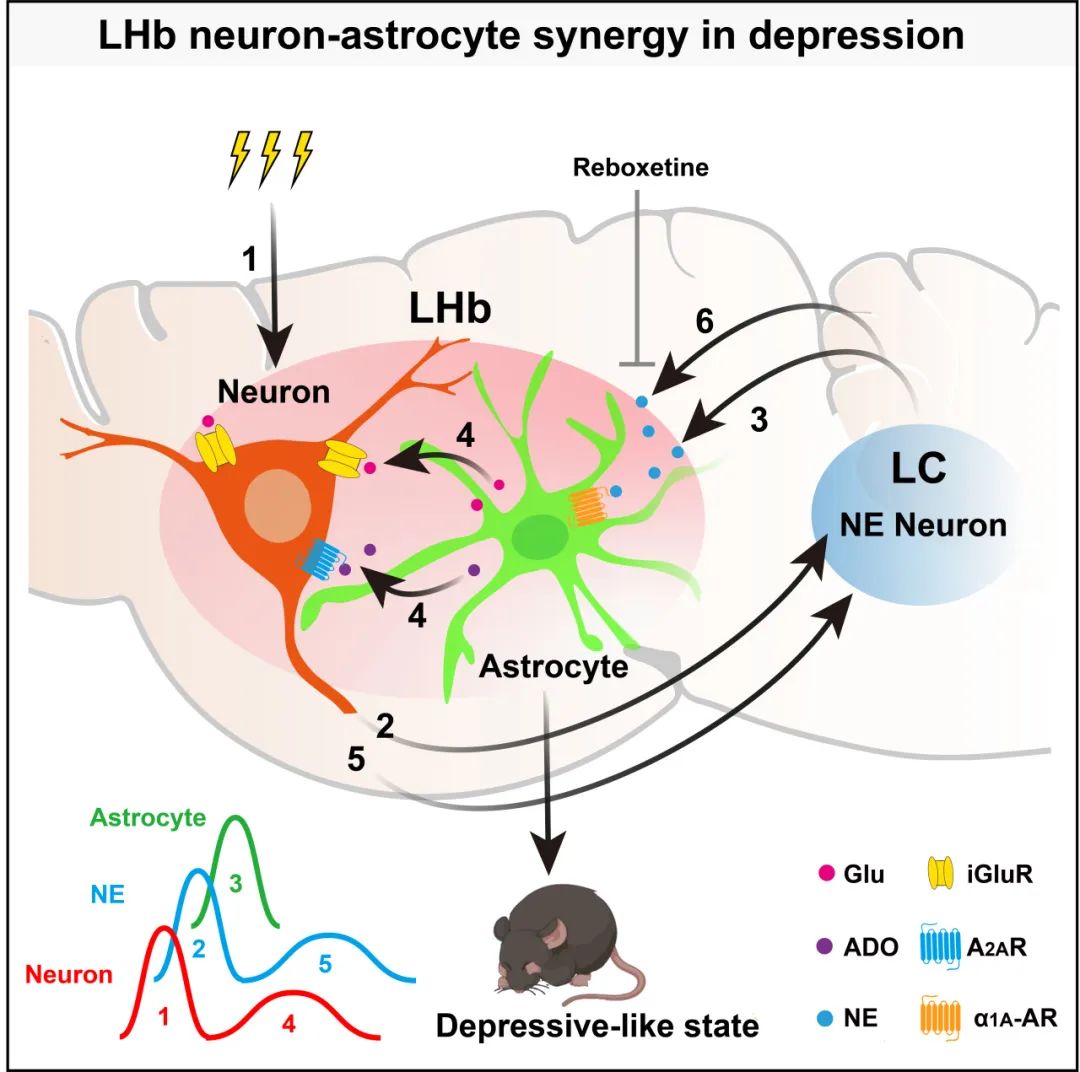
LHb和LC循环接力传递压力信息,介绍抑郁症的发生
经过一系列的实验探索,压力在大脑中的传播路径逐渐完整,大脑深处的“压力电台”也暴露在水面上,这是神经元和星形胶质细胞之间独特的双向“对话”。:当压力来临时,LHb神经元首先“觉醒”,然后远程“唤醒”LC去甲肾上腺素神经元释放去甲肾上腺素。(NE);当NE到达LHb脑区时,在“对话”中激活LHb星形胶质细胞,释放胶质递质。这样就导致了LHb神经元的第二次长时间活跃。这样就引起了LHb神经元的第二次长期活动。-压力信号就像一把回旋镖,从LHb神经元到LHB脑区转了一圈,然后又回到LHb脑区,由星形胶质细胞传回到LHb神经元。
压力电台和抑郁症
在神经科学领域,胡海岚表示,长期存在着一个重要的科学问题:为什么神经元能够在短暂的外界刺激之后继续活动?过去的理论主要是由于神经调质的缓慢作用或神经元网络的循环作用。在胡海岚团队的老鼠实验中,短短一秒钟的压力刺激导致LHb神经元和去甲肾上腺素信号持续活动约1分钟。这一独特的“神经余震”现象,引导研究小组发现了一种全新的机制:星形胶质细胞的参与。占据“C位”的星形胶质细胞在一次压力响应的“对话”中,促进了神经元的第二次长时间激活。
胡海岚说:“了解大脑如何应对压力,有助于我们更好地了解抑郁症。在动物行为实验中,随机20次左右的压力刺激导致老鼠的抑郁行为。研究小组指出,正是因为压力频繁激活了“压力电台”,使其不堪重负,最终导致了LHb神经元活动异常。
研究小组认为,压力对大脑的影响可以通过调节LHb星形胶质细胞来调节:当研究人员激活小鼠LHb星形胶质细胞时,他们的心理防线似乎明显减弱,在几次压力刺激下抑郁。而且当研究人员定向“关闭”LHb星形胶质细胞时,在超过压力刺激阀值的情况下,小鼠仍然情绪稳定。他说:“在实验中,我们发现了调节星形胶质细胞活性分子及相关受体,它们有可能成为调节抑郁症的目标。”胡海岚说。
两面“压力分子”
当我们从分子的角度“观看”大脑中压力的传递时,我们会发现一个有趣的分子——去甲肾上腺素。(NE)。是的,它是著名的“压力分子”——大脑中肾上腺素的版本,那个在考试中帮助你的分子,在赛跑中脱颖而出。在压力下,LHb神经元远程刺激蓝斑核神经元分泌去甲肾上腺素,并将其输送到全脑。
目前,NE在神经科学领域的认知仍然存在差异:羟色胺-去甲肾上腺素再摄入抑制剂(SNRIs)再摄取抑制剂,去甲肾上腺素。(NRIs)抗抑郁药作为一种经典的药物,在临床上表现出显著的抗抑郁作用。这类药物可以阻止NE的回收,提高NE在细胞外的浓度,因此假设抑郁症是由于大脑缺乏NE引起的。;不同之处在于,抑郁症患者的脑脊液和血液中的NE水平都异常上升。
他说:“在我们研究的动物模型中,NE也在增加压力来介绍抑郁情绪。”胡海岚指出,原因之一是压力压力会介绍两种NE释放方式,一种是瞬间强烈释放;另一种是持续缓慢释放。只有前者才能“动摇”LHb 星形胶质细胞。SNRIs 并且NRIs增加了缓慢释放的量,反而使NE瞬间释放受阻。星形胶质细胞在NE瞬间释放受阻时无法完成压力传递,从而阻断了压力信号的扩散。”辛倩倩说,这为临床用药中的一对分歧提供了合理的解释,启发了相关用药方法的优化。
人生,我们常常和压力不期而至。这项研究告诉我们,在压力事件解除之后,大脑还需要一段时间才能恢复活力。消化压力需要时间或方法。"要想办法阻挡压力的积累。”胡海岚说,科学研究经常暴露在压力下,特别是在探索星形胶质细胞成像和操纵工具阶段,这是团队成员压力最大的阶段。试验期间,两名博士生常常并排坐在试验台前进行试验,观察到凌晨,互相鼓励。王俊盈还在试验台上挂了一双圣诞袜子,在实验受挫时向它祈祷:“下一张脑片,一定要成功!”

浙江大学胡海岚研究小组合影合影
文字记者:查蒙 周炜 部分由医学院提供
摄影师:哲映 部分由课题组提供
原题:“这所学校,同一天的细胞” 2!》
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





