【复材信息】“自循环电化学”高效回收锂电池正极材料
选题背景
锂电池(LIBs)锂资源的广泛应用加剧了对锂资源的需求,而废旧电池回收技术仍然面临着高能耗、大量化学品消耗和污染排放等问题。虽然目前常用的火法和湿法冶金工艺可以回收金属元素,但一般涉及能源、化学或废物密集过程,存在资源利用率低、环境负担重、商品纯度有限等问题。另外,传统的湿法冶金方法回收的锂主要是以Li2CO3或Li2SO4的形式存在,而制造高镍正极材料需要LiOH,这必然会导致原材料转换的额外步骤。所以,对于可持续电池行业来说,开发一种绿色、高效、回收的电化学回收策略尤为重要。
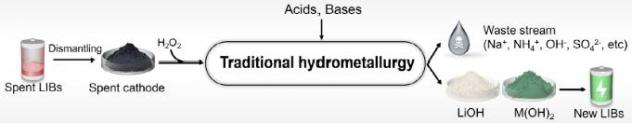
图1| 传统的湿法冶金工艺需要大量的化学物质投入,产生废水排放。
【工作简介】
本研究提出了一种利用三腔体多孔固体电解质的自循环电化学回收策略。(PSE)高锂离子传输效率的电解池(tLi⁺> 高电流强度(>100%) mALi2SO4溶液在/cm2环境下高效电解,生成高纯度LiOH和H2SO4。这种方法可以避免额外使用化学原料,并且可以回收酸/碱,从而完成零废水排放的全过程。最终回收的高纯度LiOH(>99.7%)和Co(OH)2(>99.8%)可以直接用于制造新型电池。这项研究为LIBs的可持续回收提供了一个绿色高效的解决方案。
【核心内容】
采用H2SO4等强酸浸泡正极材料,然后利用NaOH或NH4OH沉淀分离金属离子,从而导致大量化学物质投入,产生Na2SO4。、NH4 等待废水并伴有最终产物中的杂质。本研究采用电化学酸/碱再生策略,避免引入外部正离子,提高资源利用效率。另外,选择三室固体电解质电解池可以实现Li。 与传统的两内腔MEA或多内腔相比,定向转移可以提高电解的选择性和能效。
【实验原理】
本研究选择LiCoO2作为最常见、最昂贵的正极材料之一。(LCO)这种方法作为模型材料,并扩展到其它过渡元素。自循环电化学回收主要包括实现自循环利用的三个步骤:
电化学法酸/碱再生:利用三室固体电解质电解质电解池,将Li2SO4溶液电解成高纯度LiOH和H2SO4,低至0.36V的起始电压。
酸浸溶解正极材料:利用电解产生的H2SO4对正极材料进行化学计量酸浸,实现锂和过渡元素的高效溶解。
金属分离:过渡元素与锂离子分离,利用电解产生的LiOH沉淀过渡元素,分离得到Co。(OH)2、Ni(OH)二等高纯度金属氢氧化物。
回收利用:最终回收的Li2SO4溶液可以重新进入电解过程,实现自循环回收,无需额外的化学品投入。
[图文分析][图文分析]
自循环电化学电池回收系统包括以下三个主要步骤:(1)在PSE反应釜中电解硫酸锂盐,(2)溶解LiCoO2,(3)Li/Co。本工作采用三腔体PSE反应釜,结合析氢反应釜,采用有效的电化学方法从Li2SO4电解中生产酸化和碱化流。(HER)氢氧化反应(HOR)。由致密但具有透水性的正离子导电聚合物颗粒组成的中间内腔PSE层, 并且夹在中间有两种阳离子交换膜:一种用于质子交换(PEM),另外一种用于锂离子传输(CEM)。Li2SO4溶液在HER-HOR电解过程中不断通过PSE层室流动,在电场的推动下,通过PEM向中间层移动阳产生的质子,并将Li 移动到阴极室形成LiOH。PSE层不仅有利于正离子在阴极和阳极之间的高效传导和目标产物的形成,而且降低了欧姆阻抗,提高了各种电催化反应的离子传输效率和系统稳定性。

图2| 锂电池正极回收中自循环电化学策略的应用:图中,自循环电化学电池回收工艺选择 PSE 反应釜进行 Li2SO4 通过分解、酸浸和锂和过渡元素的分离( LiOH 沉淀)。所有工艺能量均来源于电能输入,最终产品为高纯度。 LiOH 和 Co(OH)2(或三元前驱体),整个过程不产生化学排放。下图,三腔电化学池配有多孔固态电解质。(PSE)电解槽设计示意图。
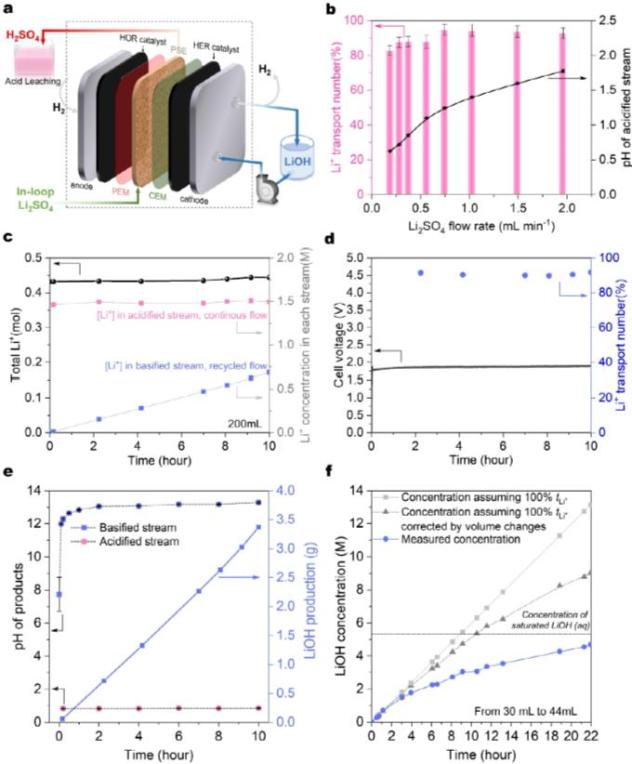
图3| 电化学酸/碱在电化学电池回收反应过程中的再生过程及性能:a, PSE 反应器电解生成盐酸和氢氧化锂的示意图,Li2SO4溶液流入中腔,产生盐酸,负极产生高纯氢氧化锂。b, 在 400 mA 电流下,PSE 反应器的 Li 转移数(tLi⁺)以及从中间内腔产生的酸性 pH 不同电解液输入流速下值的变化。c, 中间内腔产出液(红点)和负极电解液(蓝点)在一个完整的电解周期中 Li 浓度随电解时间而变化, Li 质量平衡分析。d,PSE 基于tLi的反应器电压和效率⁺)。e, 中腔酸化流和负极腔碱化流 pH 在电解周期内,值随时间变化, PSE 反应器产生的 LiOH 质量。f, PSE 反应器可以获得接近饱和的高浓度 LiOH 溶液。
根据酸浸后最终溶液的pH值(~4.0~4.8),质子利用效率在99.9%以上,这意味着在钴沉淀步骤中,负极产生的LiOH只需不到0.1%就能中和未使用的酸。与此同时,为了最大限度地通过Co(OH)2沉淀回收Co,在沉淀过程中需要适量的LiOH来提高pH值。如图4a所示,有一位代表Co2。 pH平台的沉淀过程。负极产生的LiOH大约有65%被消耗(图4a),这接近于上述定量分析中讨论的理论值66.7%,以达到这个pH值以获得更高的Co回收效率。所以,在Li2SO4盐分裂过程中,经过一个循环后剩下的35% LiOH溶液和Co(OH)2沉淀是最终产物,溶液回到Li2SO4进行下一个循环。
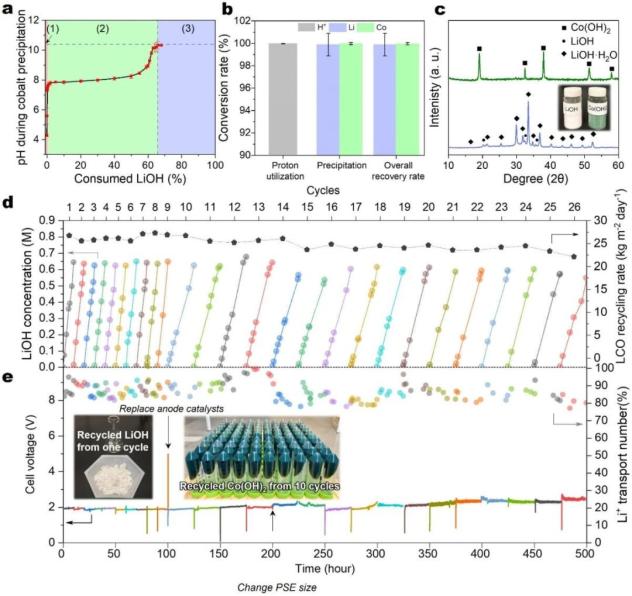
图4| LCO 阳极回收全过程:钴沉淀、商品纯度及稳定性测试:a, 在正极材料和钴沉淀过程中酸浸溶解 pH 变化图:区域(1)表示酸浸反应酸的中和(2LiOH) H2SO4 = Li2SO4 2H2O,低于1%);区域(2)表示钴沉淀过程(2LiOH CoSO4 = Li2SO4 Co(OH)2);区域(3)表示剩余区域 LiOH 作为最终的回收产品。Li2SO4溶液在区域(1)和(2)中再生。Li2SO4溶液在区域(1)和(2)中再生。b, 包括质子利用率在内的循环转化率,Li 和 Co 沉淀过程中的转换和整体转换率。c, 回收锂和钴产品的粉末 XRD 图片和照片。d, PSE 电化学法酸/碱再生反应釜稳定性测试(Li2SO4电解液在每圈前循环后再生). e, PSE 电池电压及反应器质量, 以及高纯度LiOH和CooH的再生(OH)2。
电化学电池的回收策略可以从LCO正极扩展到其他锂金属氧化物正极材料。我们选择了NMC是电动汽车中最常用的正极材料 为了测试PSE反应器的适用性,LiNi1/3Mn1/3Co1/3O2。
图5| NMC自循环电化学工艺 利用拓展正极材料回收及技术经济分析:a, 在NMC正极材料回收过程中,PSE反应釜的电池电压和效率(高于90%)。b, 金属回收效率为NMC。c, 回收的 NiCoMn(OH)x 锻造后的过渡金属氧化物(Co3O4) 和 粉末的NiCoMnO4 XRD 图谱。d-f, 技术经济分析自循环电化工工艺成本分解(TEA)以及主要能耗分解。
最后,作者通过EverBatttt, 与Aspen模型分别对废旧电池的处理和晶体和过滤分离过程的成本进行了评估,后两者的成本分别为每吨LIBs。 294.9美元和298.6美元。碳足迹的再结晶、过滤和电解能耗分别为2.70。、0.37和0.74 GJ/t,大约3.81的总能耗 GJ/t。可以看出,自循环电化学在优化电解过程后的主要能耗来自于重结晶过程,涉及到大量的挥发性水分,这表明在此过程中生产高浓度碱性溶液以减少系统中添加的水分的重要性。在计算废弃锂离子电池的成本和预处理费用后,处理废弃锂离子电池的总成本约为 8.9 每吨千美元。这种成本有望通过回收产品的市场价值(基于当前市场价格)来抵消,例如,如果只考虑在这个过程中回收。 0.14 吨 LiOH∙H2O和 0.31 吨 Co(OH)其市场总额约为2 12 千美元。所以,这种工艺在经济可行性方面具有一定的优势。
【结论】
该研究设计了一种高效的自循环电化学正极回收工艺,实现了从废旧电池正极中高效地分离和回收Li和过渡元素。Li2SO4溶液通过电化学方法分离为LiOH和H2SO4,实现酸碱再生,实现对废弃正极材料中锂和过渡元素的化学计量精确分离。这种方法不需要输入外部酸/碱化工品,不仅避免了废液处理过程,而且减少了最终产品中隐性正离子污染。LiOH(纯度>99.7%)和CoH是最终获得的(OH)2材料回收率分别超过91%和97%(纯度>99.8%),可直接用于新型电池制造。这个方向的未来研究将重点提高固体电解质层Li 电导率进一步提高了电解过程的能量效率。另外,在可持续电池行业和金属回收应用领域,设备的规模化、过渡元素的进一步分离和净化将有利于该方法。
免责声明:中国复合材料协会微信微信官方账号发布的文章仅用于复合材料理论知识和市场信息的交流与分享,不用于任何商业目的。如果任何个人或组织对文章版权或其内容的真实性和准确性有疑问,请尽快联系我们。我们会及时处理。
继续滚动阅读下一个轻触阅读原文。

学会向上滑动中国复合材料,看下一个。
原题:“复材资讯”“自循环电化学”高效回收锂电池正极材料”
阅读原文
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





