《科学》杂志发表华中农业大学研究成果
《科学》是北京时间2025年2月21日凌晨。(Science)该杂志发表了华中农业大学韩语元教授团队带头完成的名字。Base-modified nucleotides mediate immune signaling in bacteria"研究成果。该团队发现了一种细菌抗噬菌体免疫信号通道,其中以碱基装饰核苷酸为第二信使,被称为“孔明系统”(Kongming),该机制通过“借用”噬菌体本身的成分来激活免疫反应,为了了解微生物之间的生存博弈开辟了新的视角。
免疫信号传递领域的重大进展

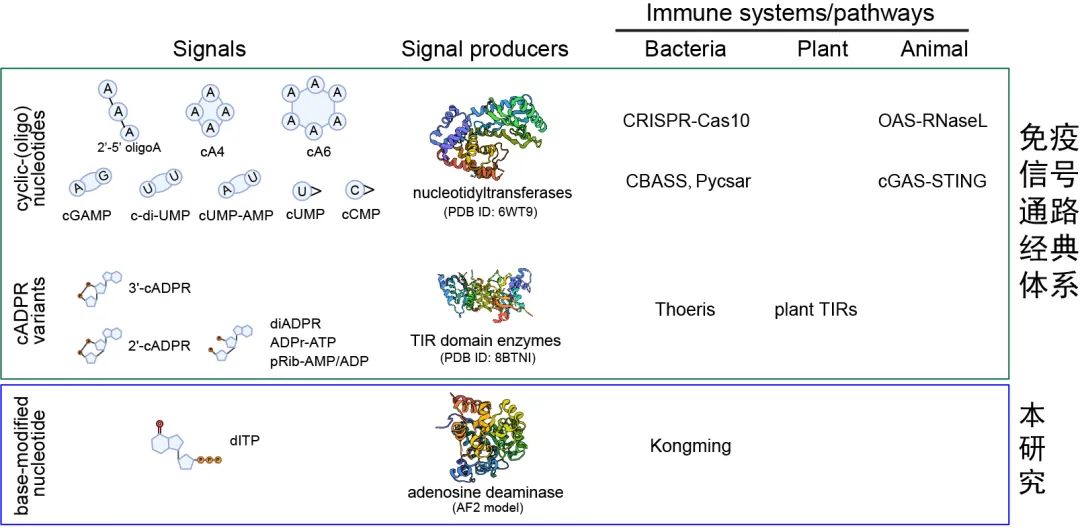
生物体内的信号传递就像一个精确的通信网络,而核苷酸分子长期被称为关键的“信号兵”。环形核苷酸(如cAMP)发现于20世纪50年代(如cAMP)、cGMP)到目前为止,科学家们已经分析了它在代谢调节、免疫应答等方面的核心作用,并多次获得诺贝尔奖。近几年的研究表明,细菌利用环形核苷酸抵抗噬菌体(感染细菌的病毒)的机制与人类免疫系统的进化有关。
通过独特的碱基装饰,本研究发现的“孔明系统”产生了非典型的核苷酸(non-canonical nucleotides)突破了这个经典的理论体系,作为第二信使。
“草船借箭”式的防御智慧

通过基因分析,研究小组锁定了一个三基因操纵子,并将其命名为“孔明系统”。该系统代码腺苷脱氨酶(KomA)、NTP焦磷酸酶HAM1非典型嘌呤(KomB)蛋白质含有SIR2样结构域。(KomC)。
当噬菌体侵入时,其携带的脱氧核苷酸激酶(DNK)事故成为激活细菌免疫的“开关”:KomA“劫持”DNK,普通核苷酸(dAMP)将其转换为特殊信号分子dITP。这一分子可以激活NAD在KomC蛋白分解细胞中的必需物质⁺,导致噬菌体因“能源枯竭”而无法复制。令人惊讶的是,这个系统巧妙地利用侵略者编码的酶来完成防御,就像三国时期诸葛亮“草船借箭”的策略一样,所以被称为“孔明系统”。
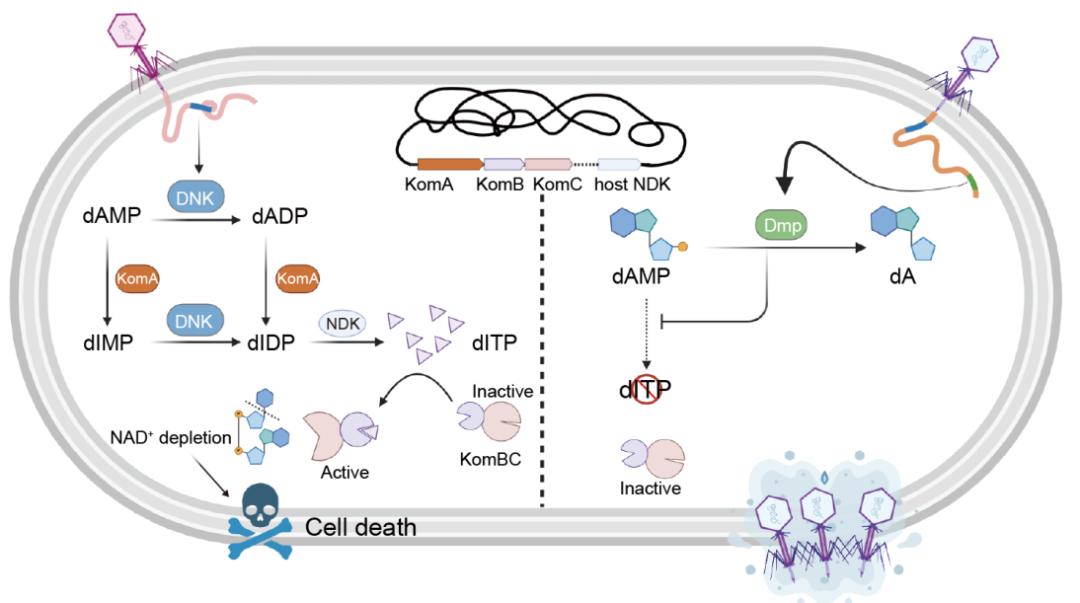
图1. 孔明信号通道(左)和噬菌体的免疫逃逸机制(右)
面对细菌的绝地生存,噬菌体也进化出抵抗策略。以T5噬菌体为例,其分泌的Dmp酶可以准确降解孔明系统的启动原料DAMP,使得免疫信号无法传递。这场“矛盾与盾牌”的较量揭示了核苷酸代谢战,这是一场全新的微生物世界生存竞争层面。
有望突破局限前景

研究表明,“孔明系统”广泛存在于各种细菌中,其模块化结构(核心KomB-KomC组合可变KomA)提醒大自然可能会出现更多未知的核苷酸通信系统。
本研究首次揭示了非典型核苷酸作为细菌免疫信号分子的功能,突破了免疫信号通道的经典体系,不仅开辟了非典型核苷酸信号传导的全新研究领域,还为非典型核苷酸的生理功能提供了后续跨物种研究的突破性研究范式。
其特异性识别dITP的特点更具医学应用潜力:未来可以开发便携式核苷酸检测工具,帮助诊断遗传代谢疾病(如ADA缺乏症)和监测抗癌药物的疗效,突破目前依靠大型仪器的检测技术的局限性。
韩国元团队博士生曾志锋、研究生胡泽予、饶继凯、哥本哈根大学博士生赵瑞亮(韩国元团队硕士毕业)是本文第一作者。国家重点实验室、湖北洪山实验室韩语元教授、哥本哈根大学助理教授Rafael Pinilla-这篇论文的共同通讯作者Redondo。Marioo大学博士生刘艳梓、刘顺航、冯浩、陈玉、陈诺和哥本哈根。 Rodríguez 参与一些研究工作的Mestre。彭东海教授、郑金水教授、何欢博士、山东大学佘群新教授、新加坡国立大学骆敏教授参加了华中农业大学合作研究。
文章链接:(点击左下角阅读原文可直接跳转)
https://doi.org/10.1126/science.ads6055
END
文 | 曾志锋
编辑 | 匡敏
审校 | 蒋朝常 徐行 晏华华 杨正莲
请按照下列格式标明转载来源。↓↓↓
华中农业大学官方微信(微信号:hzau_news_center)
阅读原文继续滚动阅读下一个轻触阅读原文。

向上滑动华中农业大学,看下一个
题目:《科学》杂志发表华中农业大学研究成果》
阅读原文
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





