为什么马斯克的“盲目”不能超越人们的眼睛?
文 | 追问 nextquestion
我经常想,如果上帝给了我三天光明,我最想看什么?还是我会怎么享受这份幸福?当我这样想的时候,请考虑一下。请考虑一下这个问题。如果你只有三天光明,你会如何使用你的眼睛?你最想让你的眼睛停留在哪里? ?——海伦 · 凯勒
生活在一个多彩的世界里,我们总是珍惜海伦。 · 凯勒失明的遭遇,被她对光明世界的无限憧憬所感动。在现实生活中,世界上至少有。 22 亿万人的视力受损或失明。视觉皮层恢复技术的发展,尤其是近年来对视觉皮层假体的研究,给他们带来了一线希望。然而,即使我们恢复了视力,我们如何知道他们看到的世界是什么样的?
虽然目前正在进行三种视觉皮层假体的临床试验(其中一种使用表面电极, Second Sight Medical Products 公司研发的 另外两个项目是Orion1,2,深部电极。 第三,第四,但是我们还不能预测假体植入后视力能恢复到什么程度。另外,神经植入领域仍然依赖于直觉和经验,这可能会导致严重的直观谬误。
最近发表于 Scientific Reports 的文章中 五是华盛顿大学的 Ione Fine 和 Geoffrey M. Boynton 描述了一种基于视觉皮层(V1)神经生理结构的“虚拟患者”模型,成功预测了人类皮层刺激研究中参与者形成的广泛感知体验。模拟结果表明,更多更小的电极无法保证更好的视力恢复。在可预见的未来,皮层假体设备的感知质量可能更受视觉皮层神经生理组织的限制,而不是技术限制。
01 当前视力恢复技术及难题
当前,各种视力恢复技术正在全球范围内密集开发。至少有8个团队正在开发视网膜电子植入物,其中两个已经被允许用于病人。 6 – 其它设备正在进行临床试验 13。光学遗传是另一个有前途的研究方向,初步数据显示,临床试验报告显示视力恢复有限。Leber 先天性黑蒙基因治疗已获临床许可,许多其它基因治疗正在发展。视网膜上皮和干细胞移植也在迅速发展, I/II 临床试验正在进行中。另外还有其它各种有前途的治疗方法正在开发中。
但这些疗法都是视网膜干扰,不能治疗视网膜脱离或视网膜神经节细胞或视神经不可逆损伤等疾病,如儿童先天性青光眼。这种情况极大地引起了人们对通过修复大脑皮质视觉中枢来恢复视力的兴趣。自 2017 到目前为止,已经开始了三个视觉皮层假体的临床试验。尽管这些临床试验是基于大量的现有文献(详细表格) 1)短期和长期皮层刺激效果同时得到检验。但是,到目前为止,这一系列研究的结果几乎完全是描述性的。
现在,在视觉皮层植入人类之前,我们无法预测其恢复视力。神经植入领域仍然依赖于直觉和经验。例如,从直觉上看,我们会认为更多、更小的电极可以带来更好的分辨率。但是具体情况真的是这样吗?
▷表 1 论文描述了人类皮层的电刺激感知效果
Ione Fine 团队 14 基于基础的建立 V1 区神经生理结构的计算模型或“虚拟患者”已经成功预测了许多已经表达人类皮层刺激的感知体验,包括人类感知的位置、大小和亮度,以及由电刺激引起的时空形状,并试图在将人类植入视觉皮层假体之前预测其形成的感知体验。
02 “虚拟病人”处理数据不足问题
基于之前对视网膜假体的刺激模型,Ione Fine 该团队提出了一个创新的理论框架。他们在时间上整合了皮层植入物中的电流,并将其转化为神经信号强度。具体来说,这种模式对刺激神经元人群产生的感知是基于每个细胞的感觉野的线性求和,并根据每个位置的神经信号强度随时加权。尽管这种模式在数学原理上简单明了,并且没有经过复杂的参数调整,但是它已经成功地预测了各种皮层刺激数据。

▷Fine, Ione, and Geoffrey M. Boynton. "A virtual patient simulation modeling the neural and perceptual effects of human visual cortical stimulation, from pulse trains to percepts." Scientific Reports 14.1 ( 2024 ) : 17400.
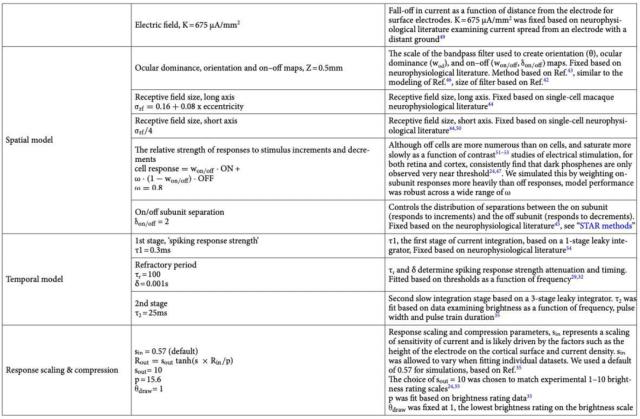
(1)从脉冲序列到感知强度的时间转换。
模型设计中,Ione Fine 团队使用了一个快速的时间整合阶段,这个阶段经常被认为是细胞即时整合电流的过程,以产生“峰值活动强度”的衡量标准。在一次激活后,他们进一步假设了一个峰值的不应期,即细胞需要一段时间才能再次响应刺激。随后,该模型进入了一个相对缓慢的整合阶段,并引入了如图所示的压缩非线性关系。 1 所示。
为实现这一过程,他们使用了一种简单而完美的单阶段泄漏积分器进行建模。该积分器中,去极化速度与当前的去极化水平和输入电流成正比。也就是说,电流的变化会直接影响细胞的极化速度。在模型的第一阶段,“峰值响应强度”的输出不仅代表了单个峰值,也反映了来自不同激活敏感细胞的峰值募集状况。在这个细胞群中,压缩非线性关系不仅可以捕捉到饱和现象,而且可以反映出更复杂的皮层增益控制系统。
▷图 1. 从脉冲序列到随时间变化的感知强度转换示意图。
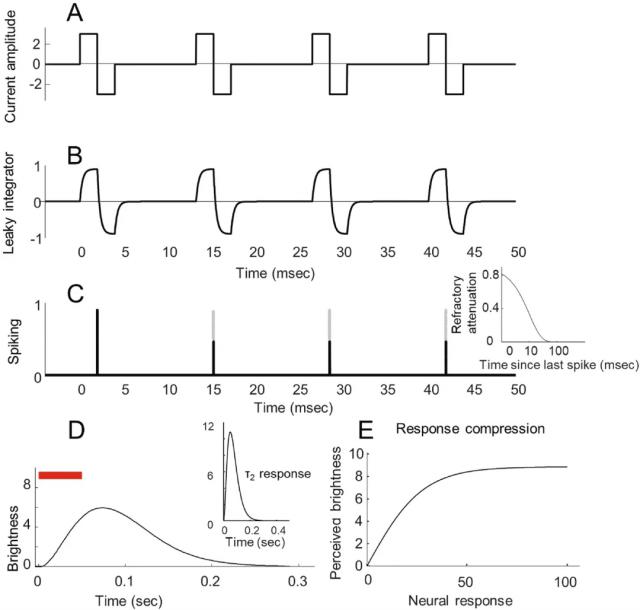
(2)视觉主导柱、方向针轮和感觉野性
对于我们如何感知和处理视觉信息,初级视觉皮层(V1)中存在着复杂而有序的神经结构。图 2 基于 Rojer 和 Schwartz 工作,展示这些结构的模拟结果。对视觉方向敏感的方向柱(图) 2B),是通过随机白噪声信号带滤波获得的,其滤波后的视角反映了神经元对不同方向的偏好。Ione Fine 随后,该团队扩展了模型,并加入了视觉主导柱(图) 这些主导柱是沿单个方向对同一白噪声信号的梯度,从而形成正交排列的视觉主导柱和方向柱。这类柱形结构与猕猴和人类实际测量的视觉主导和方向柱图高度相似。
单一感觉野(图片) 2F)是负责接收和处理视觉系统中光信号的基本单位。采用简单的模型生成,通过加性组合“开”和“关”子单元,从单峰分布中分离出子单元的空间。同一区域的通滤波白噪声用于生成方向和视觉主导图,也用于生成控制“开启”和“关闭”感觉野分离(δ on – off)和“开”和“关”感受野的相对强度。(won-off)的图。
预测光斑是根据该位置的电刺激强度加权,通过将每个皮层位置感受野的轮廓线性相加。这意味着电极位置的刺激强度直接关系到感知光斑的亮度和大小。
▷图 2. 皮层模型示意图
( A ) 从视觉空间到皮层表面的转换。 ( B ) 方向针轮图。 ( C ) 眼睛位置优势列。 ( D ) ON 和 OFF 亚单位空间分离。 ( E ) ON 与 OFF 相对强度。 ( F ) 感受野大小。
(3)作为电刺激时间特征的光幻视阀值和亮度函数
Ione Fine 该团队将模型预测与各种脉冲序列中测量的电流幅度阀值和亮度评级数据进行了比较。该模型可以准确描述脉冲序列如何随着时间的推移转化为感知强度,然后在各种脉冲参数、电极位置和电极尺寸下成功预测光幻阀值和亮度评级。这就是说,无论电刺激次数、脉冲宽度或电极的具体位置和大小如何变化,模型都可以可靠地预测患者的感知体验。
光幻阀值是指产生能见光点所需的最小电流强度,而亮度等级则是病人对光斑亮度的主观评价。
光幻视大小与电流幅度和偏心率之间的关系
除此之外,Ione Fine 团队 1 该模型还成功地预测了光幻视的大小如何随电流幅度和视觉场偏心率而变化。调查显示,随着电流范围的增大,光幻视的大小也随之增大,这与病人的具体感知数据密切相关。它表明,电流幅度是决定光斑大小的关键因素之一。另外,模型还显示,随着视觉偏心率的增加,光幻视的大小也在增加。这就是说,电刺激位于视线边缘,会比中心产生更多的光斑。
(5)形状识别
在研究中,团队比较了两种不同的电刺激方式形成的感知体验,即同时刺激。数据显示,当多个电极同时受到刺激时,模型无法正确识别完整的字母形状,这与患者的实际体验是一致的。然而,当电极按照写作顺序依次受到刺激时,模型可以准确识别字母形状。这一发现揭示了一个关键点:与此同时,在刺激过程中,感知光斑难以正确分组和解释,而按顺序刺激则能形成可识别的形态。
这种情况可能来自于格式塔效应的失败。格式塔心理学强调,整体大于部分之和,这表明我们的感知系统侧重于将分布的光斑整合成有价值的整体。然而,由于模型不包括电场或复杂的神经时空交互,与此同时,光斑不能正确分组,造成形状识别困难。而且顺序刺激通过时间分离,减少了光斑间的影响,促使感知系统能更有效地整合信息,正确识别形状。
用“虚拟病人”来预测新设备的感知结果。
Ione Fine 团队模型可以复制如此广泛的数据,这表明它可以提供洞察新技术可能的感知体验——这是“虚拟病人”模型的重要用途之一。
图 3 利用“虚拟病人”模型探索不同大小电极可能出现的感知体验。图 3A 在中间,模拟阵型采用了极小的电极(尖端面积介于 500-2000 μ m ² 模型预测的视觉光斑显示出与初步测试数据一致的结果:相邻电极之间的光斑无法清晰区分。这种预测与病人的预实验观察一致,表明当电极刺激间隔在 0.4 至 1.85 在毫米之间,不管是单个还是多个电极的刺激,都会产生不规则形状的光斑。这就是说,使用极小的电极可能同时伤害神经元人群的调谐方向相似,导致感知光斑显示出拉长或复杂的结构。
图 3B 和 3C 对电极大小对患者感知的影响进行了进一步研究。对电流扩散有限的小电极(刺激性皮层组织半径小于 0.25 mm),如图所示,模型预测产生的光斑结构复杂。 3B 上半部分显示,此时电极的大小对光斑的外观或大小影响不大。电极半径为 0.25 mm到 1 在毫米之间,光斑开始与“高斯斑”相似(Gaussian blob),但是斑点的大小仍然主要取决于感觉野的大小,而不是刺激区域的扩展范围。仅超过电极半径 1 在mm时,电极的大小会显著影响光斑的大小。
关键是,模型描述在整个视觉领域,感觉野在生理上对光斑的大小施加了“下限”。具体而言,将刺激区域的半径缩小到 0.5 低于mm,或许不会显著提高视力,反而会导致光斑难以解读。
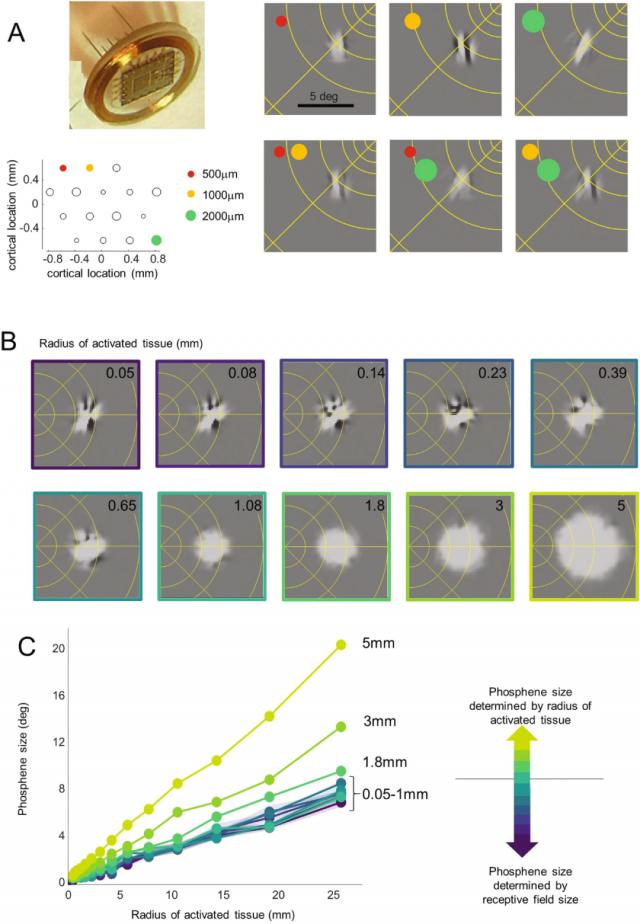
▷图 3. 利用“虚拟病人”来预测感知结果
( A ) 模拟感知,包含很小的深层电极阵型。在阵型中,下左面板显示电极的位置和大小。右上面板显示了三个独立电极的示例感知。在刺激成对电极组合时,下面板显示了预测结果。 ( B, C ) 模拟预测感知的形状和大小显示在不同的电极大小和皮层位置。面板 C 狭小的阴影区域表示内部的狭小阴影区域 5 – 95% 置信区间。
同样,更多的电极能带来更好的视力恢复吗?
Ione Fine 团队通过图 4 模拟了三种不同电极阵型的感知结果,揭示了这个问题的复杂性。
图 4A 显示了电极在视觉空间中规则排列的情况。这种排列方式在中央凹区(视网膜上负责高分辨率视力的区域)产生稀疏的小光斑,显然低估了该区域的感知能力。这意味着,虽然电极数量增加,但中央凹区的光斑分布不够密集,不能充分利用该区域的高分辨率潜力。
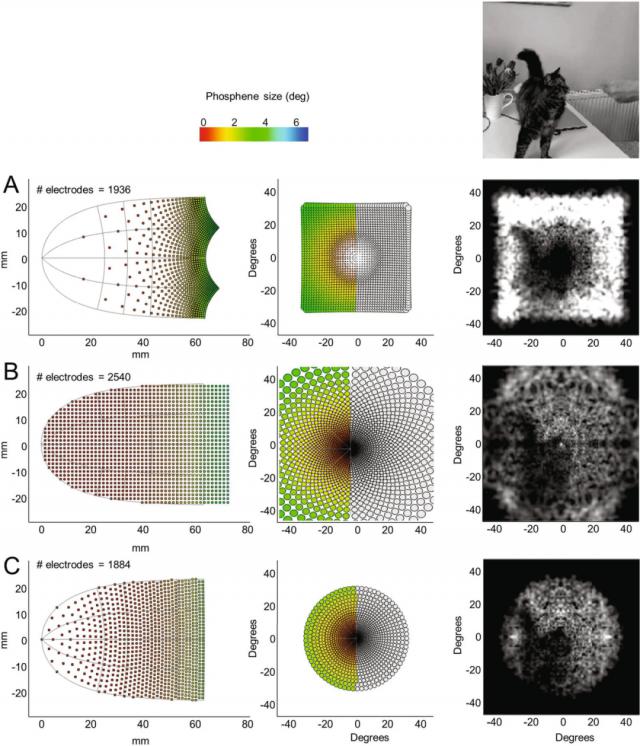
▷图 4. 对不同电极阵型的模拟进行比较。 ( A ) 电极规则间隔布局在视觉场。 ( B ) 电极规则间隔布置在皮层表面。 ( C ) “最佳”间隔。
图 4B 在大脑皮层表面显示电极的规则排列。这类设备的问题在于,中央凹区的电极过于集中,导致感觉野间出现大量重叠。因此,这些重叠的感觉野并没有实质性地提高分辨率。事实上,中央凹区附近的电极几乎投射到同一个视觉空间位置,这使得患者很难察觉到光点的位置变化,即使电极位置发生微小变化。这种发现挑战了传统观点,即认为 V1 中央凹区的普遍扩展可以支持较高的空间坐标采样能力。
图 4C 展示了一种“最佳”电极设备,即电极间隔被设计成激发光斑中心间距与光点大小的固定比例。由于感觉场的大小随视觉场的偏心度线性增大,而皮层放大效应则以大多数方式发生变化,这种最佳配置在中央凹区的电极分布比周围区域更为松散。结果表明,电极应该更分散地布置在中央凹区,而不是密集排列,这与常见的直觉相反。
Ione Fine 团队模拟结果显示,中央凹区域集中电极排列过多不利于提高感知分辨率。相反,基于神经生理的约束,电极的位置和间隔可以合理分布,从而最大限度地发挥视觉皮层假体的感知效果。
03 “虚拟病人”模型的启发
“虚拟患者”模型解决了视力恢复开发中的根本问题——植入物在植入体内前无法预测患者的感知体验。通过这种模式,研究人员可以预测和评估不同电极设计和刺激参数对视觉感知的影响,而无需实际植入。
另外,这个模型也解释了一个关键误区:增加电极的数量或减小电极的大小,并不一定能带来更好的视觉感知效果。反之,甚至会导致感知体验的复杂性。
Ione Fine 团队模型揭示了皮层植入物空间分辨率有限的三个主要因素:皮层放大率、感受野性结构和电极大小。感觉野的大小与皮层放大率密切相关。在大多数皮层区域,感觉野面积与皮层放大率相似。 2/3 第二方,这个解释 Bosking 在等待之前,可以通过皮层放大率来预测患者绘制的光幻视觉的大小。在中央凹区,皮层放大率达到最高值,所以野大小达到最小值,半径为 0.02 到 0.5 度之间。
数据和模拟结果表明,对于固定电极尺寸,光幻视的大小随偏心率线性增加。半径小于 0.25 毫米电极,这种线性相关主要是由于感觉野的大小随着偏心率的增加而增加。只有当电极尺寸较大时,光幻视的大小才会受到皮层放大率和刺激性皮层范围的显著影响。
对较小的电极而言,感觉野的大小成为影响视觉清晰度的主要因素。。若能有选择地刺激具有特别小感觉野的神经元,则在中央凹区的电极间隔可以更加紧密,从而达到更高的空间分辨率。但是,值得注意的是,人类能够识别出极其微妙的空间细节,这些细节远远小于单一感觉野的宽度。这些细致的空间分辨率取决于对不同感觉野的神经元人群复杂反应模式的解读,而不仅仅是单个神经元的感觉野。
综合而言,Ione Fine 在未来可预见的时期内,团队模拟说明,与工程设计相比,视觉皮层假体的空间分辨率更容易受到视觉皮层神经生理结构的限制。这意味着,为了提高视力恢复的效果,研究人员不仅要追求更多或更小的电极设计,还要深刻理解和应用视觉皮层神经的生理结构特征。
04 当前“虚拟病人”模型不足
“虚拟患者”模型创新了医学界对视网膜植入手术的认知。虽然建模技术早就被用来模拟电刺激对局部组织的影响,比如电极的电流扩散,但是如果虚拟模型没有扩展到基本的生理原理,感知结果是无法预测的。
Ione Fine 团队简单的“虚拟患者”模型成功预测了广泛的皮层电刺激感知结果,表明它可能为未来的视网膜或视觉皮层植入物提供合理的感知结果相似度。因此,未来的研究方向将有更可靠的“受试者”数据作为研究内容的指导。
但是他们的模型仍然有优化的空间。首先,目前的模型使用电流范围作为输入参数。理论上,更准确的方法是利用电流强度(电流强度除以电极面积)来更准确地反映组织中电流的分布和作用。
其次,Ione Fine 团队 1 假设电极与皮层表面齐平。在实践中,电极不太可能与表面齐平,甚至与皮层表面相比,电极的轻微倾斜也可能导致神经反应的高效驱动。
第三,模型应该被视为类似的模型,不适合推广长期刺激方案。第四,模型不包括电场或非线性神经的相互作用。第五,模型假设感知是每个感觉野的简单平均值。另一种方法是假设每个神经元更适合用它的“最佳重构滤波器”来表示细胞对神经人群中自然图像重构的贡献。
最后,目前的模型只包括在内 V1 皮层区域。由于皮层表面的结构,在较高层次的视觉区域(例如 V2 或 V3 区域)植入电极要容易得多。模型的许多部分,包括从视觉空间到皮层表面的转换,都可以很容易地推广到这些更高的视觉区域。模型也能很容易地扩展到包括 V2 或 V3 神经元感觉野模型。然而,V2-V3 神经元感觉野性结构的复杂性,加之缺乏来自 V2 或 V3 电极皮层刺激数据表明,目前所有这类模型的推广都是非常推断的。
05 未来展望
这些“虚拟患者”模型未来可以提供多种用途。对于研究人员和公司来说,一方面可以定量检测我们是否对技术有全面的了解。由于收集行为皮层数据的难度较大,模型驱动的方法可以有效指导哪些实验可以获得最宝贵的观点,提高研究资源的分配。
另外一个重要目的是预测植入物可能出现的视觉质量。在本文中,Ione Fine 在评估不同阵型配置时,团队依赖于对感知质量的定性评估。一种更加严格的方法是关注主观可解释性:通过使用模拟假体视觉来感知视力正常的个体。或者使用模拟作为解码器的输入图像,解码器训练有素地生成原始输入图像的重建。最近使用的皮层模拟器类似于更复杂模型中的一些现象。
最后,这些“虚拟病人”能够引导新技术的发展。例如,如上所述,当前模型反直觉地表明,小电极尺寸和密集植入在中央凹区域的优点是有限的。“虚拟病人”也可用于生成基于深度学习的假体视觉优化训练集,旨在为当前植入物找到最佳的刺激模式。目前,通过生成深度学习基础的预处理训练集,在虚拟现实环境中模拟和优化假体视觉,正在使用类似的视网膜刺激模型。
对于 FDA 以及医疗保险等机构,这些模型可以在评估产品时提供重要的视觉测试意见,帮助制定更合理、更科学的评估标准,保证新型视觉恢复技术的安全性和有效性。最后,这些模型将为外科医生和患者家庭提供更现实的感知结果预期。
参考文献:
1. Beauchamp, M. S. et al. Dynamic Stimulation of Visual Cortex Produces Form Vision in Sighted and Blind Humans. Cell 181, 774-783.e5 ( 2020 ) .
2. Bosking, W. H. et al. Saturation in phosphene size with increasing current levels delivered to human visual cortex. Journal of Neuroscience 37, 7188 – 7197 ( 2017 ) .
3. Gabel, V. P. Artifi Cial Vision A Clinical Guide.
4. Fern á ndez, E. et al. Visual percepts evoked with an intracortical 96-channel microelectrode array inserted in human occipital cortex. Journal of Clinical Investigation 131, ( 2021 ) .
5. Fine, I. & Boynton, G. M. A virtual patient simulation modeling the neural and perceptual effects of human visual cortical stimulation, from pulse trains to percepts. Sci Rep 14, 17400 ( 2024 ) .
6. da Cruz, L. et al. Five-Year Safety and Performance Results from the Argus II Retinal Prosthesis System Clinical Trial. Ophthalmology 123, ( 2016 ) .
7. Stingl, K. et al. Subretinal Visual Implant Alpha IMS - Clinical trial interim report. Vision Res 111, ( 2015 ) .
8. Ayton, L. N. et al. First-in-human trial of a novel suprachoroidal retinal prosthesis. PLoS One 9, ( 2014 ) .
9. Lorach, H. et al. Photovoltaic restoration of sight with high visual acuity. Nat Med 21, ( 2015 ) .
10. Fujikado, T. et al. One-year outcome of 49-channel suprachoroidal – transretinal stimulation prosthesis in patients with advanced retinitis pigmentosa. Invest Ophthalmol Vis Sci 57, ( 2016 ) .
11. Saunders, A. L. et al. Development of a surgical procedure for implantation of a prototype suprachoroidal retinal prosthesis. Clin Exp Ophthalmol 42, ( 2014 ) .
12. Sommerhalder, J. & P é rez Fornos, A. Artificial Vision A Clinical Guide. Artificial Vision ( 2017 ) .
13. Palanker, D., Le Mer, Y., Mohand-Said, S. & Sahel, J. A. Simultaneous perception of prosthetic and natural vision in AMD patients. Nat Commun 13, ( 2022 ) .
14. Fine, I. & Boynton, G. M. A virtual patient simulation modeling the neural and perceptual effects of human visual cortical stimulation, from pulse trains to percepts. Sci Rep 14, 17400 ( 2024 ) .
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com


