【复材资讯】剑桥大学,Nature!
选题背景
单碳同系物是一种具有相同结构和功能的有机分子,它们的链长不同于亚甲基基。(–CH₂–)单位。在许多分子类别中,如药物、天然产品、农业化学品、香料和石油产品,同系物成员的物理化学特性略有不同,可能导致功能明显不同。因此,分子发现计划中有效产生同系物是关键策略。
关键问题
但是,单碳链在烯烃中的延长主要存在以下问题:
1、单碳同系化缺乏直接适用于烯烃的方法。
目前还没有一种方法可以直接和普遍地应用于烯烃的单碳同系化。传统的扩链过程通常需要多步反应,如碳-碳双键氧化裂化、Levine-Wittig反应,酸介导水解,Wittig-亚甲基化等,这些步骤繁琐,生成效率低下。
2、当前的合成步骤与复杂的结构和敏感官能团不兼容。
现有的多步生成过程不仅繁琐,而且往往与氧化敏感官能团不兼容,难以应用于结构复杂的分子。这限制了它在药物化学等需要复杂结构的行业的广泛应用。
新思路
正是这样,剑桥大学Matthew J Gaunt等人报道了一种催化单碳同系化过程,它对许多简单而复杂的分子中的烯烃类型有效。一种流线型的锅法,包括交叉易位和断裂/逆烯级联,通过使用新型多面烯丙基试剂的固有反应性,在烯烃链上正式插入亚甲基模块。在几种结构和功能复杂的分子中应用该方法,作者证明了这种实际转换是如何产生以前没有研究过的环孢菌素-A同系物的。这些同系物表现出调节的药学和生长习性,可以作为亲环素抑制剂提供有前途的主导作用,这是许多疾病领域潜力巨大的目标。
技术规范:
1、单碳烯烃同系物战略的发展
本研究制定了基于丙烯酸框架的1CTR试剂,通过一锅法实现烯烃的交叉位置,形成1、2-2替代的丙烯酸。尾端烯烃通过乙烯损失实现单碳结合,然后通过两个阶段的同源过程将烯烃转移到链延长的末端产物。
2、烯烃同系化是通过一锅法完成的。
作者制定了基于烯丙基砜框架的1CTR试剂,通过一锅方法实现了烯烃的单碳同系化。该方法具有广泛的官能团兼容性,为抗病毒药物的扩展或同源组合提供了有效的方法。
3、对单碳同系化战略的高效性进行了验证
研究证实,单碳同系化战略可以高效生成他克莫司,简化步骤,产率53%,并成功应用于生成多种烯烃和大环化合物,扩大了生成应用范围。
4、探讨了环孢菌素A中单碳同源反应的应用。
研究发现,单碳同系化策略可以延长环孢菌素A侧链,产生多种类似物质,发现其免疫抑制能力和钙调神经磷酸酶抑制活性发生显著变化,为新型亲环素抑制剂的设计提供了新的策略。
技术优势:
1、报告了单碳同系化过程,对简单复杂分子中的多种烯烃进行有效催化。
作者利用新型多面烯丙基试剂的固有反应性,完成了包括交叉位置和断裂/逆烯级联在内的流线型一锅法,然后在烯烃链上正式插入一个亚甲基模块。这种方法避免了传统多步生成的繁琐过程,提高了生成效率。
2、多功能单碳转移试剂基于烯丙基础框架的制定
本工作制定了多功能单碳转移试剂,通过烯烃交叉易位反应形成1、2-2替代的烯丙基苯。尾端烯烃通过乙烯损失实现单碳结合,然后通过氧保护基团断裂和甲醛去除,将烯烃转移到链延长的末端产物。
技术细节
单碳烯烃同系物策略
该研究的核心是制定多功能单碳转移试剂(1CTR),该试剂基于烯丙基础框架。1CTR的碳-碳双键通过一锅法转换,可以通过烯烃交叉易位反应偶联,形成1,2-2替代的烯丙基(潜在的同系物)。乙烯内部损失在尾端烯烃的前提下,造成单个碳原子净结合。为了防止不可控的烯烃延伸,选择了两个阶段的同源流程:复分解反应后,第二阶段是由氧保护基团的原点断裂和甲醛消除引起的,产生的烯丙基亚磺酸自发回复反应,将烯烃转移到链延伸的末端烯烃产物。
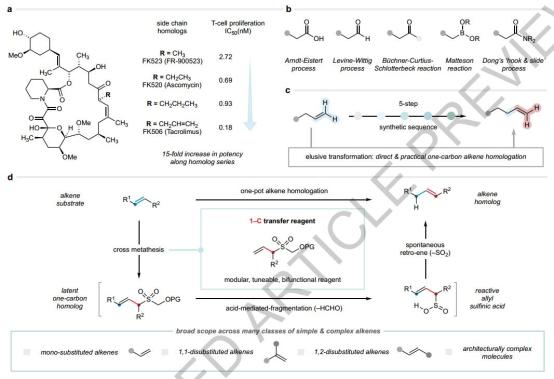
图 单碳烯烃同系物战略的演变
单碳烯烃同系化工艺
该研究设计了一种多功能单碳转移试剂(1CTR),基于烯丙基础框架,通过一锅法实现烯烃的单碳同系化。选择叔丁基二甲基硅烷基(TBS)在弱酸性环境下,作为保护基团,可以裂化,促进逆烯反应。在实验中,Hoveyda-Grubbs第二代催化剂和4当量1CTR-1a被用来完成潜在同系物的定量生成。对酸敏感基团,选择较温和的反向烯方案。该方法对各种结构和功能基团具有广泛的兼容性,包括极性官能团和自然产品。例如,它已经成功地完成了同系物化的产物,如鲟烯香紫苏醇、毛喉素、烯丙基雌三醇等。此外,该方法还成功地应用于复杂药物分子的合成,例如将抗病毒药物Grazoprevir的ACCA模块转换成丙基环丙烷类似物,产量为43%。这种策略提供了一种有效的方法来快速生成抗病毒备选物的扩环或同源组合。
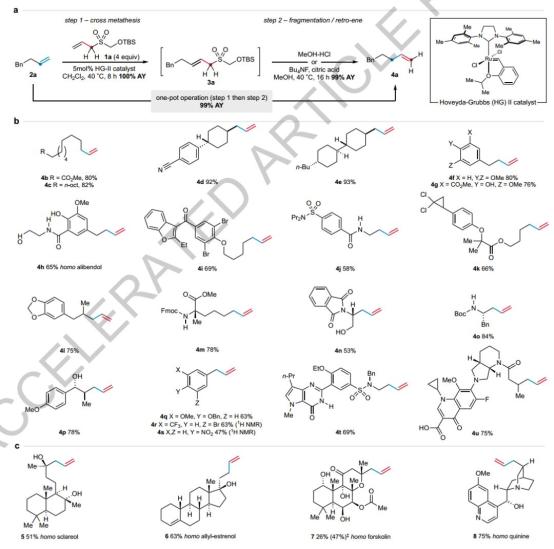
图 开发单碳烯烃同系化工艺
单碳烯烃同系物结构复杂分子
这项研究进一步验证了单碳同系策略的高效性。通过将其应用于复杂药物他克莫司(FK506)的合成,将原本需要7个步骤的生成过程简化为一个步骤,完成了53%的生产率。此外,该方法还成功应用于二次替代烯烃的同系化。通过引进羟基替代基,完成了1、1-二次替代烯烃(如鱼藤酮)的高效转换,产率达到73%。这种策略也扩展到了内烯烃的同系化,产生了适合天然产品、香料和农业化学品的有价值的新型类似产品。尾端烯烃的两碳链延伸通过使用不同替代基的1CTR试剂,在环烯烃的环扩张中显示出其生成潜力,成功地将17元大环Ambrettolide扩展到19元大环,产量极佳。这些结果表明,单碳同系化方法具有广泛的生成应用价值,可以显著简化复杂分子的合成路径,为自然产品和药物分子的结构调整提供新的方法。

图 单碳烯烃同系物结构复杂分子
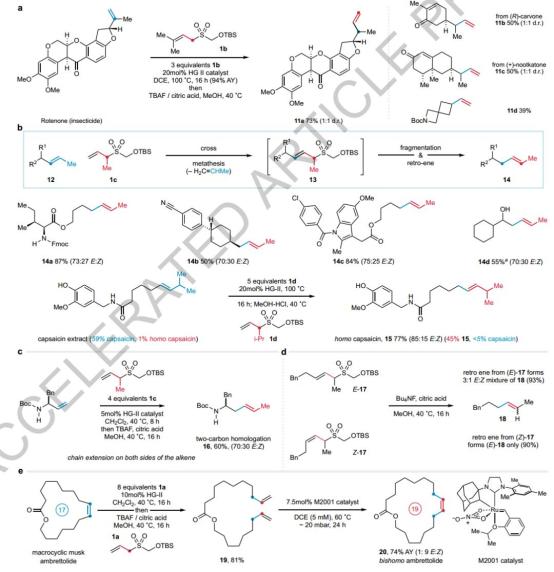
图 同系化的双替代烯烃
生物学评价环孢素A的同系物及相应同系物。
通过延长其烯烃侧链,本研究将单碳同系化策略应用于环孢菌素A(一种重要的免疫抑制剂)的合成,成功地合成了单碳和双碳同系物(21和22),并保留了E-烯烃的选择性。这类同系物在高浓度下表现出与环孢菌素A相当的免疫抑制能力,但在低浓度下,单碳同系物21的免疫抑制能力明显下降。进一步的体外实验表明,单碳同系物21的钙调神经磷酸酶的抑制活性降低了3.5倍,而双碳同系物22与环孢菌素A保持了同等的活性。另外,引入不同的替代基(例如CD)₃在钙调神经磷酸酶抑制活性方面,合成了多种类似环孢菌素A,这些类似物在钙调神经磷酸酶抑制活性方面有显著差异。特别是氟化类似物24的磷酸酶活性明显下降。这一结果表明,即使是细微的结构装饰,如链长、烯烃位置和单原子替代,也会显著影响环孢菌素A的生物活性。这一发现为环孢菌素衍化亲环素抑制剂的设计提供了新的策略,尤其是在非免疫抑制应用方面。
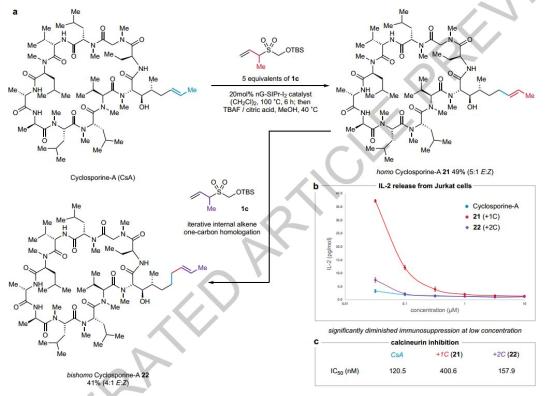
图 生物学评价环孢素A的同系物及相应同系物。
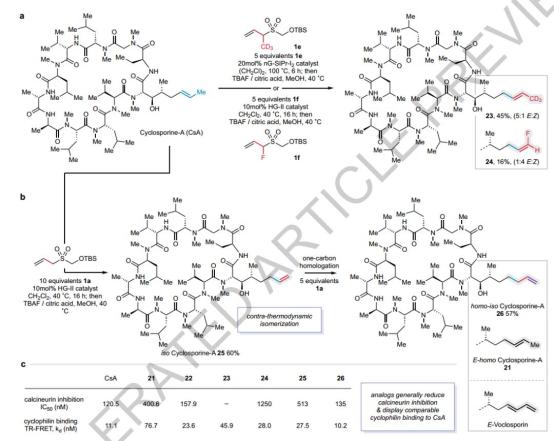
图 新型环孢素A类似物的合成及其生物评价
展望
由于缺乏柔和、实用、有选择的合成方法,很少探索复杂分子中单碳同系物引起的微小结构修饰,往往忽略了有价值的结构——活性关系和生物学进步。本文介绍的烯烃同系物策略为获得未开发的烯烃同系物提供了一种简单通用的方法,包括环孢菌素A的衍生物,可以系统地编程烯烃侧链的功能特性和长度。这种方法有望扩展到FK506等其他钙调神经磷酸酶抑制剂,成为构建复杂分子的合成工具包的有价值拓展,在学术和工业机构中有着显著的应用。
免责声明:中国复合材料协会微信微信官方账号发布的文章仅用于复合材料理论知识和市场信息的交流与分享,不用于任何商业目的。如果任何个人或组织对文章版权或其内容的真实性和准确性有疑问,请尽快联系我们。我们会及时处理。
继续滚动阅读下一个轻触阅读原文。

学会向上滑动中国复合材料,看下一个。
原题:剑桥大学《复材信息》,Nature!》
阅读原文
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





