押注实体瘤与通用型CAR - T双赛道,科济药业能否突出重围
《科创板日报》11月22日讯(记者 史士云)在近期结束的商保创新药目录价格协商中,“百万天价CAR - T产品”再次引发行业高度关注。
这款因远超医保“保基本”承受阈值,连续多年未进入医保谈判的创新疗法,此次有5款产品获得与国家医保局协商的资格。业界普遍希望通过这一支付新途径打开突破口,提高产品的临床可及性。
《科创板日报》记者了解到,截至目前,国内已上市8款CAR - T产品,各产品靶点和获批适应症不同,但都面临商业化落地难题。
具体来说,主要集中在三个方面:一是成本高,“一患者一批次”的个性化制备模式,涉及细胞采集、基因修饰、扩增质检等多环节,且依赖进口材料,数据显示,CAR - T产品单针成本超50万元;二是制备复杂,全流程需数周,批次间稳定性难控制,部分疾病快速进展患者可能错过治疗时机;三是适应症狭窄,主要集中在复发性血液肿瘤,难以形成规模化市场效应。
因此,市场观点认为,即便部分CAR - T产品成功纳入商保创新药目录,创新支付只是商业化落地的途径之一。若要进一步拓展市场,仍需从适应症拓展和底层技术革新两方面寻求突破:比如向需求庞大的实体瘤领域拓展,同时发展“现货型”通用型CAR - T、“通用化”方案体内CAR - T(在患者体内直接将T细胞改装成CAR - T细胞)等前沿技术,通过技术迭代降低成本、提高可及性。
▌突破血液瘤局限,全球首款实体瘤CAR - T产品进入审批关键期
“针对实体瘤治疗的舒瑞基奥仑赛注射液预计明年上半年获批上市,目前该产品技术审评环节已完成,审评进展积极。”科济药业联合创始人、董事长李宗海在公司日前举行的投资者开放日上透露。
据悉,舒瑞基奥仑赛注射液是一款靶向Claudin18.2的自体CAR - T细胞产品,今年6月提交上市申请,用于治疗Claudin18.2表达阳性的晚期胃/食管胃结合部腺癌。若顺利获批,将成为全球首款治疗实体瘤的CAR - T细胞疗法。
此前,科济药业的自体BCMA(B细胞成熟抗原)靶向CAR - T细胞疗法沃基奥仑赛注射液已于去年3月获国家药监局批准上市。
据科济药业业绩报,依靠该产品的商业化销售,今年上半年为公司带来约5100万元收益,从商业化合作方华东医药获得111份有效订单。
目前,全球获批上市的CAR - T疗法适应症均为血液瘤,尚无针对实体瘤的产品获批。
优替济生联合创始人宋晓东对《科创板日报》记者表示:“实际上,血液瘤在肿瘤新发例数中仅占10%,而实体瘤占90%。与传统化疗的全身性毒副作用相比,CAR - T疗法靶向性更强,可减少对正常组织的损伤,降低脱发、恶心、骨髓抑制等不良反应,提高患者治疗期生活质量。对于传统治疗无效的晚期实体瘤患者,该疗法有望缩小肿瘤甚至完全缓解,显著延长总生存期,部分患者可能长期生存甚至临床治愈。”
“多项实体肿瘤相关临床试验数据显示,实体肿瘤领域CAR - T产品的不良反应发生率,如细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)等,明显低于血液肿瘤领域同类产品,安全性优势突出,值得肯定。”北京大学肿瘤医院一期临床病区副主任齐长松说。
然而,CAR - T疗法要突破实体瘤治疗瓶颈,仍需克服诸多障碍,脱靶毒性是核心挑战之一。当前实体肿瘤CAR - T治疗的靶点不仅在肿瘤细胞表面表达,也在正常组织中表达,导致CAR - T细胞在杀伤肿瘤细胞时,可能攻击正常组织,引发不良反应。此外,肿瘤微环境的抑制作用、抗原异质性等难点,也是CAR - T治疗实体瘤需要解决的问题。
在开放日上,齐长松介绍,舒瑞基奥仑赛注射液选择Claudin18.2靶点,是解决肿瘤微环境难题的关键。多项研究发现,Claudin18.2阳性肿瘤细胞周围免疫微环境活跃,聚集大量免疫细胞,且PD - 1等免疫抑制信号为阴性,仅缺乏特异性识别靶点,补充Claudin18.2识别信号可引导CAR - T细胞精准杀伤,从根本上解决了实体瘤微环境问题。
目前,科济药业还尝试将舒瑞基奥仑赛用于其他实体瘤的加强辅助治疗,今年10月,该产品用于胰腺癌辅助治疗试验的初步结果已在2025年ESMO上公布。
宋晓东认为,实体瘤的复杂性将推动CAR - T技术升级,如新型CAR结构设计(如双特异性CAR、条件激活CAR)、联合疗法(与免疫检查点抑制剂联用)等技术将快速成熟,同时带动基因编辑、细胞制备等配套技术革新。
朴拙资本执行合伙人苗天一站在资本市场角度表示:“针对实体瘤治疗的CAR - T产品是市场的‘圣杯’,与已实现商业化突破的血液肿瘤相比,实体瘤患者群体庞大,临床需求未得到满足,市场潜力巨大。该领域的技术突破将打开千亿级增量市场,成为推动行业发展和资本价值释放的关键。”
▌通用型CAR - T破解“天价”困局,商业化落地仍需多重考验
近年来,通用型CAR - T(uCAR - T)凭借“现货供应”优势成为细胞治疗领域的热门赛道。
与传统自体CAR - T“一患一批次”的个性化制备模式不同,通用型CAR - T以健康捐赠者的T细胞为原料,经基因编辑改造后批量生产、冷冻储存,可“即取即用”,不仅大幅缩短治疗等待周期,还通过规模化生产降低单位成本,有效解决了自体CAR - T制备周期长、成本高的问题。
在本次投资者开放日上,科济药业重点介绍了其在通用型CAR - T领域的布局。
科济药业临床科学副总裁罗毅表示:“从临床应用价值看,一方面,部分患者自身T细胞功能衰退,基因编辑后难以发挥肿瘤杀伤作用;另一方面,随着医疗技术发展,免疫治疗应用场景向疾病早期延伸,许多患者在前期治疗中已接受免疫治疗,T细胞免疫潜能被充分调动,后续治疗需替代方案,通用型CAR - T为这部分患者提供了新选择。”
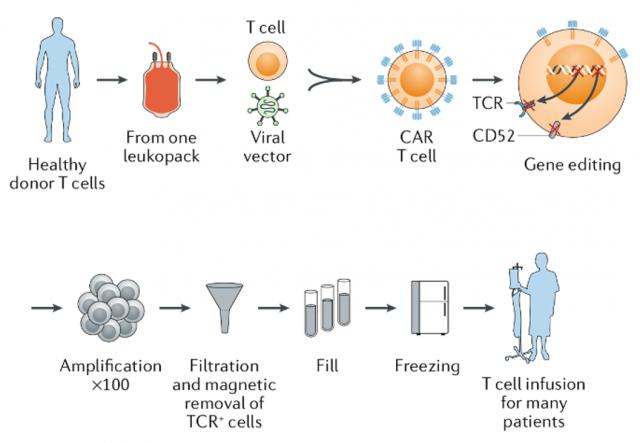
图 | 通用型CAR - T制备流程,来源:Nature Reviews Drug Discovery
《科创板日报》记者从开放日了解到,尽管通用型CAR - T有诸多优势,但其临床实际疗效有待进一步验证。已发表的数据显示,与自体CAR - T相比,通用型CAR - T在有效率和缓解持续时间上有提升空间,主要原因是其细胞扩增水平未达自体CAR - T,难以在治疗早期形成优势并深度清除肿瘤。
导致通用型CAR - T扩增能力受限的主要原因是宿主抗移植物反应(HVGR),即宿主免疫细胞对异体细胞的识别与攻击,这是通用型CAR - T面临的最大挑战,影响CAR - T细胞存活和药物疗效。
为避免宿主T细胞对同种异体CAR - T细胞的排异,通常敲除B2M基因,但缺乏B2M基因的同种异体CAR - T细胞会被宿主NK细胞排异,导致其增殖和持久性降低。
据罗毅介绍,为解决上述问题,科济药业使用THANK - uCAR技术,将识别NKG2A的CAR装载到同种异体CAR - T细胞中,阻止NK细胞攻击。同时,NK细胞可增强uCAR - T细胞扩增,NKG2A敲除可进一步增强T细胞功能。
目前,科济药业已开发THANK - uCAR平台、THANK - u Plus技术平台,并基于THANK - u Plus平台开发了通用型产品CT0596(靶向BCMA)和CT1190B(靶向CD19/CD20)。
另据《科创板日报》记者了解,科济药业还在开发不同靶点的通用型CAR - T候选产品,涵盖实体瘤、血液肿瘤、自免CAR - T领域,涉及CLDN18.2、GPC3、B7H3、NKG2DL、BCMA/GPRC5D等多个靶点。
“当前,投资者关注点从‘疗效多好’转向‘成本多低’。CAR - T疗法百万定价源于其高度个性化、工艺复杂的生产模式。因此,技术迭代和成本控制能力是投资机构评估企业的首要因素,企业技术路线选择至关重要。通用型CAR - T作为中期内最现实的降本途径,预计单患者成本可降至自体的三分之一到二分之一,和现在的体内CAR - T都是资本关注的赛道。”苗天一指出。
产业研究人士周晓(化名)对《科创板日报》记者表示,尽管通用型CAR - T解决了自体CAR - T“个性化、慢、贵”的问题,但其临床疗效需更大范围验证。此外,通用型CAR - T进入商业化阶段后,T细胞来源问题亟待明确,如依赖健康供者捐献还是其他合规渠道获取,需行业探索和规范。
目前,国内除科济药业外,北恒生物、邦耀生物、博生吉、优赛诺生物等企业均布局通用型CAR - T,普瑞金、元码智药等企业入局体内CAR - T。
CAR - T疗法的生产工艺是其从实验室走向临床应用、实现商业化的核心,其成熟度和稳定性决定了疗法的规模化供应能力。
苗天一表示,生产工艺革新意义重大,如引入自动化封闭式生产系统,可将CAR - T细胞制备周期从两周以上缩短至数十小时,成本降低超40%。这种技术降本能力决定了产品市场可及性和支付方接受度。
据科济药业联合创始人、首席运营官王华茂介绍,公司生产工艺分为自体CAR - T和通用型CAR - T生产工艺,前者周期为7 - 14天,后者30小时内可完成生产,实现关键工序自动化,单批次产量可达100人份以上。
在产能方面,《科创板日报》记者获悉,由于科济药业金山工厂设计产能有限(2000人份),公司正推进涵盖自体和异体CAR - T细胞制造能力的一体化智能细胞制造中心建设,预计年产能提升至数万人份。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com




