明确了“先进治疗药物”的定义:影响几何?
21 世纪经济报道记者 闫硕 北京报道
最近,国家医药产品管理局药品审评中心(CDE)《先进治疗药物的范围、分类和定义(征求意见稿)》(以下简称《征求意见稿》)的发布,明确了“先进治疗药物”的范围和定义、具体分类和分类的整体原则和科学逻辑。公开征求意见的时间限制为 6 月 10 日起 1 个月。
先进治疗领域是“生命科学”的关键跑道,是培育未来产业、促进生物经济高质量发展的“新生产力”之一,占据生物制造创新战略高地,国际竞争日益激烈。然而,我国先进医疗药物的范围和类别划分仍然缺乏法律法规的定义和行业共识。这些药物的研发、技术审查和监督面临许多挑战。
金春林,上海市卫生与健康发展研究中心主任, 21 据《世纪经济报道》记者介绍,《征求意见稿》的内容主要集中在基因治疗、细胞治疗等基于微生物或组织工程的创新药物上,这些药物是最具革命性和最需要特殊监管的前沿产品。与此同时,意见稿明确排除了传统的预防性疫苗、抗生素、血制品等。另外,基于商品的作用机制,草案建立了科学、可操作的分类系统,明确了各类产品的监管规定。
“这一次,为先进医疗药物全生命周期控制体系的建设奠定了基础。虽然公司短期内可能会面临新的合规成本压力,但中长期内会大大促进创新转型,吸引投资,优化资源配置,提升国际竞争力。”金春林补充道。
如何定义?
近年来,随着生物技术等前沿技术的蓬勃发展,以细胞治疗药物和基因治疗药物为代表的一类药物在世界范围内的研发、申报和许可数量不断增加,在癌症、罕见遗传病等疑难重症的临床治疗方面取得了突破。目前,中国的细胞治疗产业已经进入与国际先进水平“并驾齐驱”的新阶段。
需要指出的是,“过去,我们的细胞治疗、基因治疗等前沿产品可能散落在药物、生物制药甚至医疗器械的监管框架中,缺乏明确的定义和规范,导致R&D企业、监管部门和医疗机构在分析产品属性和审查路径方面存在一些困惑。而且传统的监管框架主要针对化学药品和生物制药,很难完全适应一些先进的治疗药品。”金春林说。
CDE 文件中强调,“这类药物具有很强的创新性和复杂性,需要科学谨慎的监督,以确保药物的安全性、有效性和质量可控性。“当前,国际主要药品监管机构正在对先进治疗领域的法律法规和监管框架体系进行统筹规划。为了规范我国先进医疗药物的范围和分类,促进分级分类科学控制,帮助控制与国际接轨,CDE 制定了相关文件。
根据《征求意见稿》,结合我国产业发展和控制现状,参照国际药品监督管理机构的命名规范,突出此类药物的创新特点,将符合解读特点的一类产品命名为“先进治疗药物”,英文名称仍然遵循国际命名规范,称为“ Advanced therapy medicinal products ",缩写为 ATMPs。
先进的治疗药物包括三类:细胞治疗药物、基因治疗药物和其他药物。其中,细胞治疗药物包括两个亚类,即非基因修饰细胞药物和体外基因修饰细胞药物;基因治疗药物还包括四个亚类,包括核酸药物、病毒载体药物、溶瘤微生物药物和基因编辑药物。
伴随着科学技术的发展和研发的推动,这类产品的亚类归属也将逐步完善。
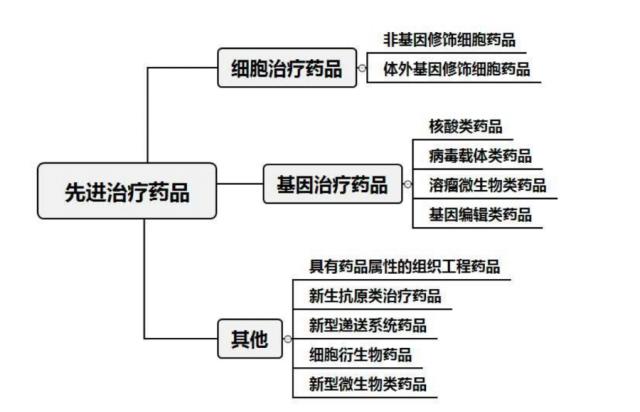
先进药物具体分类及亚类示意(来源:CDE)
同时,参照 WHO、欧洲药品管理局(EMA)等级分类标准和我国生物制药注册分类情况,定义“对正常人使用的抗感染性疾病的预防性疫苗” ATMP “针对肿瘤和肿瘤的范围; / 或者是其它疾病进展等治疗性疫苗。 ATMP。
影响几何?
毫无疑问,明确的先进治疗药物范围、分类等定义将对公司产生一定的影响。
金春林指出,合规成本可能会在短期内增加。企业需要投入资源来理解和适应新分类系统下的具体要求,调整R&D管道和生产工艺的质量控制,建立符合先进医疗产品要求的 GMP 管理系统和追溯系统,所以成本可能很高。但从中长期来看,有望优化成本。由于路径和确定性明确,反复探索和沟通的成本降低。针对性的要求避免了原有控制方式的一些不适应,可能会降低不必要的科研要求。
先进的药物治疗市场前景广阔。就我国市场规模而言,仅干细胞治疗就已经超过了 200 1亿元。2024年前瞻研究院 2024年中国干细胞产业市场研究报告 预计中国干细胞市场的规模将达到。 265 其中,采集、制备和储存领域的市场规模接近1亿元。 160 一亿元。但是,中国的干细胞存储率远低于发达国家,市场潜力巨大。
另外,《基因治疗药物产业发展白皮书》显示,2025年 预计中国基因疗法年度市场规模将达到 25.9 亿美金,2025-2027 年有望达 500 亿元。
最终的《征求意见稿》将对整个行业产生巨大的影响。首先,金春林表示,将加快创新成果的转化。明确的监管路径和预期可以使创新产品的转换更加方便,从实验室向临床和市场推广更多先进的医疗产品。第二,也有助于吸引投资。明确的监管框架大大降低了政策的不确定性风险,可以吸引国内外资本进入这一领域,为产业注入发展动力。第三,将提高产业集中度,加快专业分工,资源可能会聚集在头部企业。
“不仅如此,还会促进整个产业链的成熟,促进培养液、病毒载体等上游原材料的快速发展,以及下游物流追溯系统等配套产业链,促进整个生态的发展。此外,它将提高国际竞争力。建立符合国际标准的监管机制,让中国先进的医疗产品参与全球竞争,有利于中国商品出海和国际项目的实施。”金春林说。
值得一提的是,《征求意见稿》提出,与国际分类规范相比,中国这次更具前瞻性和包容性,同时给予新技术。 / 新产品 / 新型模式预留了界面或空间,未来可以根据技术发展和产品研发的推动,与时俱进,及时更新。
这也涉及到如何在实际评价中平衡监管和创新。金春林表示,应以科学为基础,分类管理,评价要求与监管强度相匹配,对高风险商品要求更加严格,在保证安全的前提下,可以尽快推出低风险产品。同时,要明确产品质量是关键,评价重点要放在与商品安全性和有效性直接相关的关键参数和环节上,不要过多纠结一些不太重要的细节。另外,在保证安全、有效的前提下,鼓励采用先进的分析方法和生产工艺。
“总的来说,《征求意见稿》和未来的一些实施方法将深刻影响中国生物医药产业的未来格局,促进中国在世界尖端治疗领域发挥更重要的作用。”金春林说。
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





