2024年,全国医疗器械优先审核商品达到101件。
2025-01-29
2014年,NMPA推出了《创新医疗器械专项审批程序(试行)》,经修订,于2018年正式发布实施《创新医疗器械专项审查程序》。具有核心技术发明专利、技术原理领先、技术实力国际领先、临床治疗价值显著的国内医疗器械优先考虑。2024年优先评估渠道也迎来了许多创新产品的诞生,为我国医疗器械创新的发展贡献了中坚力量。
第一,整体情况
据高端医疗机构统计,2024年,共有71家企业的101款产品进入优先审核渠道,其中20款进入国家优先审核渠道,81款进入省级优先审核渠道。

图表1 截至2024年全年医疗器械进入优先审核通道状况
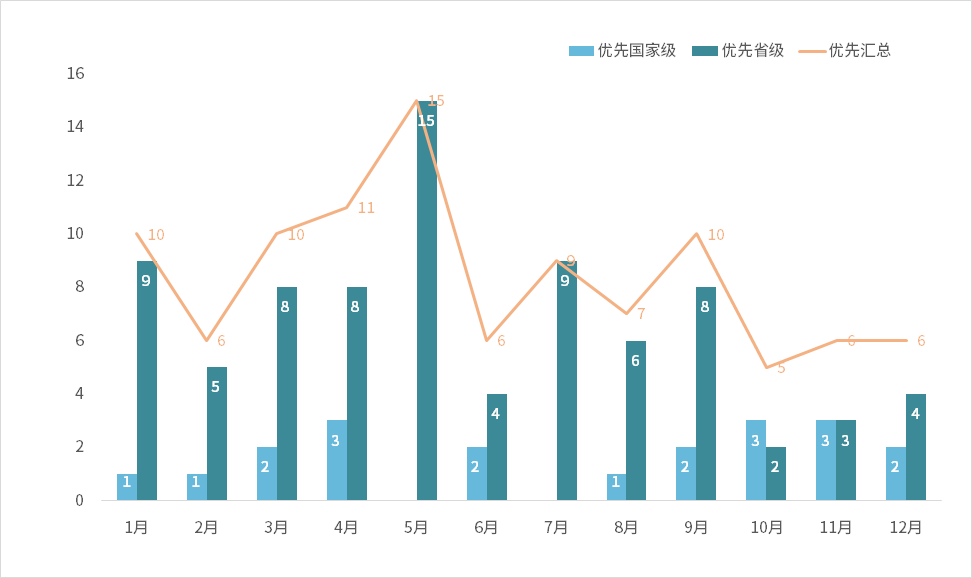
资料来源:作者整理
第二,区域分布
江苏省(17件)是2024年全年进入优先审核渠道的前三个省市(17件)、重庆(16件)和天津(14件)。
图表2 2024年全年各地区医疗器械进入优先审核通道状况
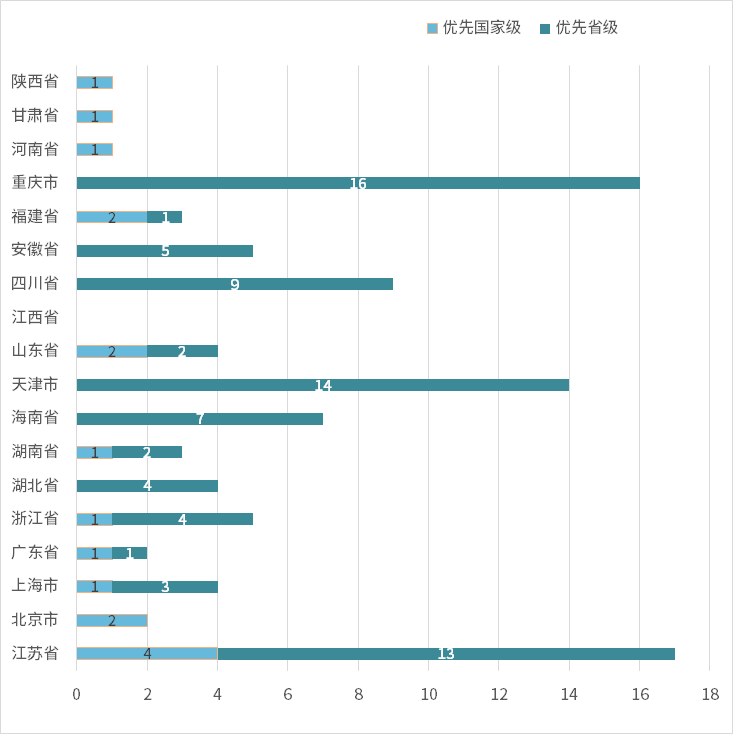 资料来源:作者整理
资料来源:作者整理
第三,产品类别
在2024年进入优先审核渠道的产品中,20个国家级产品中有3个是进口产品,17个是国产产品,81个是省级产品。
在进入优先审核渠道的产品中,体外诊断试剂(28件)是商品数量排名第一的产品类型,医用显像设备和医用检验设备排名第二,均为10件。
图表3 2024年全年进入优先审核通道产品类别状况
资料来源:作者整理
其中涌现出各种创新的医疗器械产品,让医疗器械领域的创新产品百花齐放。随着未来产品的正式上市,将惠及更多患者。
注意:请注明转载来源
本文仅代表作者观点,版权归原创者所有,如需转载请在文中注明来源及作者名字。
免责声明:本文系转载编辑文章,仅作分享之用。如分享内容、图片侵犯到您的版权或非授权发布,请及时与我们联系进行审核处理或删除,您可以发送材料至邮箱:service@tojoy.com





